|
昆仑雪菊水溶性黄酮提取物对D-半乳糖致衰老小鼠学习记忆障碍的改善作用昆仑雪菊水溶性黄酮提取物对D-半乳糖致衰老小鼠学习记忆障碍的改善作用 田 勇1,周 督2,邹双忆2,孙星宇2,郅 琦1,李福香1,明 建1,3,* (1.西南大学食品科学学院,重庆 400715;2.西南大学附属中学,重庆 400715;3.西南大学食品贮藏与物流研究中心,重庆 400715) 摘 要: 为探讨昆仑雪菊水溶性黄酮提取物(water soluble fl avonoids from Coreopsis tinctoria fl owers,CTWF)对D-半乳糖致衰老小鼠学习记忆障碍的影响,以SPF级昆明种小鼠为实验对象,随机分为正常组、衰老模型组、VE组(50 mg/(kg·d))和CTWF低、高剂量组(150、600 mg/(kg·d))。除正常组皮下注射生理盐水外,其余各组均注射D-半乳糖(300 mg/(kg·d)),连续42 d造模,注射1 h后,药物组分别灌胃VE和不同剂量CTWF,正常组和模型组灌胃等量生理盐水。采用Morris水迷宫测试各组小鼠学习记忆能力,并测定小鼠脑组织乙酰胆碱(acetylcholine,Ach)含量,乙酰胆碱酯酶(acetylcholinesterase,AchE)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力和丙二醛(malondialdehyde,MDA)含量。结果表明:CTWF能够显著提升衰老模型小鼠的学习记忆能力(P<0.05),并显著提高脑组织SOD、GSH-Px活力和Ach含量(P<0.05),降低AchE活力和MDA含量(P<0.05)。因此,CTWF具有明显改善衰老模型小鼠学习记忆障碍的作用,其机制可能与提高脑组织胆碱能系统功能和减少自由基损伤有关。 关键词:昆仑雪菊水溶性黄酮提取物;学习记忆能力;乙酰胆碱;超氧化物歧化酶;丙二醛 衰老是导致正常细胞调节功能障碍的重要因素,影响神经系统和免疫系统等多个系统[1],是多种慢性疾病的致病风险因素,包括癌症、心血管疾病和神经系统退行性疾病等[2]。衰老相关疾病中脑老化问题日益突出,越来越受到人们关注。脑老化是一种正常的生理现象,若脑老化急剧恶化,会导致病理性的神经系统退行性病变,最典型的是阿尔茨海默病(Alzheimer’s disease,AD),主要症状为智力、记忆力、感官定向能力、判断力、语言思维能力不可逆地进行性退化,并常伴有认知和行为障碍[3-4]。因此,不断探索具有预防脑老化、改善记忆认知能力的抗衰老功能性食品,对神经系统退行性疾病的防治具有重大意义。 昆仑雪菊,又名两色金鸡菊(Coreopsis tinctoria),属菊科金鸡菊属类一年生草本植物,原产于北美洲,现分布于世界各地。在中国广泛种植于新疆维吾尔自治区的高原积雪地区(海拔3 000 m以上),又被称为“雪菊”[5]。昆仑雪菊含有黄酮、有机酸、萜类、皂苷等多种生物活性成分,其中黄酮类化合物含量最为丰富[5-6]。昆仑雪菊用作茶饮主要的生物活性集中水溶性部分,且黄酮类化合物是其水提取物中的主要生物活性成分[7]。昆仑雪菊黄酮具有降血脂[8]、降血糖[9]、抗氧化[10-11]、抗炎[12-13]、降血压和舒张血管[14-15]等生物活性;同时,有研究发现昆仑雪菊黄酮具有良好的抗衰老[16-17]和抗神经退行性病变的功效[18],但作用机制尚不清楚。因此,本实验以D-半乳糖致衰老小鼠模型,研究昆仑雪菊水溶性黄酮提取物(water soluble flavonoids from Coreopsis tinctoria flowers,CTWF)对衰老小鼠学习记忆能力的影响,并从胆碱能系统功能和氧自由基损伤方面探讨其作用机制,以期为昆仑雪菊药食功能的进一步开发和应用提供理论依据。 1 材料与方法1.1 动物、材料与试剂SPF级昆明种小鼠:雌、雄各半,体质量(20±2)g,购自重庆中药研究院(动物合格证号:0005580)。动物全程饲养于西南大学药学院清洁级动物房(实验动物使用许可证号:SYXK(渝)2014-0002)。 昆仑雪菊(Coreopsis tinctoria)采摘于新疆昆仑山海拔3 000 m以上的高寒地区,经新疆维吾尔自治区中医院药剂科赵生俊主任医师鉴定。 乙酰胆碱(acetylcholine,Ach)、乙酰胆碱酯酶(acetylcholinesterase,AchE)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和丙二醛(malondialdehyde,MDA)试剂盒 南京建成生物工程研究所;芦丁、绿原酸、儿茶素、花旗松素、D-半乳糖美国Sigma公司;黄诺马苷、马里苷 法国Extrasynthése公司;PH1714印度墨汁 福州飞净生物科技有限公司;VE、生理盐水、无水乙醇等其他试剂均为分析纯。 1.2 仪器与设备Morris MT-200型水迷宫 成都泰盟科技有限公司;HH-6型数显恒温水浴锅 金坛市富华仪器有限公司;RE-52AA型旋转蒸发仪 上海亚荣生化仪器厂;LC-20A高效液相色谱(high performance liquid chromatography,HPLC)仪 日本岛津公司;JS10型手持匀浆机 扬州均瑞机械设备有限公司;TGL-16M型高速台式冷冻离心机 湖南长沙湘仪离心机仪器有限公司;synegyH1MG型酶标仪 美国基因公司;VIS-722型可见分光光度计 上海精密科学仪器有限公司。 1.3 方法1.3.1 CTWF的制备与组分分析 本次实验数据证明,改进后的弹力绷带小手套能够延长患儿手部留置针留置天数,并提高患儿家长的满意程度,因此,可以被广泛应用在临床医学中,以此来改善儿童患儿留置针留置情况。 实践民俗学是面向生活实践和交流实践的民俗学,而不仅是将民俗学知识用于指导实践,或者民俗学者主动参与到社会生活之中。实践民俗学首先要承认,民俗是民众的生活实践,民众的生活实践又经常表现为琐碎的生活事件。正如费特曼所言,“在很多情况下,一个事件就是一种生活方式或是一个具体社会价值观的隐喻”[注][美]大卫·费特曼:《民族志:步步深入》,龚建华译,重庆大学出版社,2007年,第79页。。当代民俗学“朝向当下”和迈向日常生活的学术实践,需要从过去的强调民俗事象研究还原到民俗事件研究,再由民俗事件研究还原到生活实践研究。 1.3.1.1 CTWF的制备 参照Zhang Weixin等[17]的方法制备CTWF,并根据实验条件稍作修改。在装有10 g昆仑雪菊的烧杯中加入100 mL蒸馏水并在沸腾的水浴锅中浸提3 次,每次30 min。所有浸提液抽滤后合并,减压旋转蒸发浓缩后冻干成粉。CTWF冻干粉的得率为(43.60±1.78)%。CTWF为胶状棕褐色固体,经鉴定其主要活性成分为黄酮类化合物[19]。 1.3.1.2 CTWF中总黄酮含量测定 参照吴瑛等[20]的方法,以芦丁为标准溶液,以吸光度(y)为纵坐标,芦丁标准溶液质量浓度(x/(μg/mL))为横坐标,绘制标准曲线。 CTWF中总黄酮含量的测定:移取1 mL稀释适当倍数的样品溶液,以不加样品溶液为空白,按制作芦丁标准曲线的步骤处理后,在510 nm波长处测得吸光度,代入标准曲线,计算出CTWF中总黄酮含量。 1.3.1.3 HPLC法鉴定分析CTWF中的活性成分 参照Liang Qiang等[21]的方法,稍作修改。采用BDS C18色谱柱(250 mm×4.6 mm,5 μm),流动相A为乙腈、B为体积分数0.1%甲酸溶液,梯度洗脱(0~5 min,10% A;5~50 min,10%~40% A;50~55 min,40%~10% A;55~60 min,10% A);流速0.7 mL/min;进样量10 μL;柱温40 ℃;检测器为LC-20A二极管阵列检测器(diode array detector,DAD);色谱数据在200~600 nm范围内扫描,检测波长280 nm。根据保留时间、液相紫外色谱图和外标法定性定量分析CTWF中的活性成分。 1.3.2 动物分组及给药处理 小鼠饲养环境为温度(25±3)℃,相对湿度(40±10)%,12 h昼夜交替,自由饮食饮水。60 只小鼠适应性喂养5 d后,按体质量随机分为5 组(每组12 只,雌、雄各半):正常对照组(normal control,NC)、模型组(model control,MC)、VE阳性对照组(VE positive control,PC)、CTWF低剂量组(low dose of CTWF-treated group,CTWF-L)和CTWF高剂量组(high dose of CTWF-treated group,CTWF-H)。除NC组外,其余各组小鼠颈背部皮下注射灭菌D-半乳糖液(CTWF灌胃剂量300 mg/kg,灌胃体积0.2 mL/10 g)构建衰老模型[16],NC组注射等体积量的灭菌生理盐水,连续注射42 d。造模1 h后,药物组(CTWF-L、CTWF-H)分别以150、600 mg/(kg·d)剂量灌胃CTWF,灌胃体积为0.2 mL/10 g;PC组以50 mg/(kg·d)剂量等体积灌胃VE溶液;NC、MC组灌胃等体积量灭菌生理盐水,连续灌胃42 d。实验期间每7 d称质量1次,按体质量变化调整注射及灌胃剂量。 1.3.3 Morris水迷宫实验 小鼠末次给药后进行Morris水迷宫实验。Morris水迷宫主要由圆形水池(直径80 cm、高度30 cm)和可移动平台(直径10 cm、高度28 cm)组成,水池连接着一个数字摄像机和一台计算机用于记录和分析实验数据。实验时将迷宫均等分为4 个象限,平台固定放置在第一象限中央,注入水后加入对小鼠无害的印度墨汁,使小鼠看不到隐藏在水中的平台,水面高出平台1~2 cm,水温保持25 ℃左右。Morris水迷宫实验包括2部分:定位航行实验和空间探索实验[22]。 定位航行实验:评价衰老小鼠空间学习记忆能力。第一次实验开始前,让小鼠自由游泳2 min以适应周围环境。正式实验开始时,选择第二、三、四象限的池壁中点作为入水点,将动物面朝池壁轻轻放入水中,避免应激和将小鼠头部浸入水中。小鼠有120 s的时间寻找平台,小鼠在平台上停留超过2 s判断为寻找平台成功,所需的时间记作潜伏期。若小鼠在120 s内找到平台,使其在平台上停留30 s记忆平台位置,并记录其潜伏期;若小鼠在120 s内未成功找到平台,则用手将其引至平台,放置30 s,使得小鼠记忆平台位置,记录其潜伏期为120 s。每天上下午各进行1 次训练,每次为1 个时段,进行3 d,共6 个时段。记录每个时段小鼠找到平台所需的潜伏期。 第三,通用性强。由于激光聚焦深度大,淬火时对零件的尺寸、大小及表面都没有严格的限制。而现有的中高频感应淬火对各种零件都得制作合适的感应器。 空间探索实验:评价衰老小鼠空间位置记忆保持能力。定位航行实验结束后,移去平台,将小鼠从第二、三、四象限的某一点面向池壁放入水中,记录其在120 s内穿越目标象限(原平台所在第一象限)的次数,即穿越次数。 1.3.4 脑组织SOD、GSH-Px、AchE活力及MDA、Ach含量的测定 Morris测试完成后,小鼠禁食不禁水24 h,颈椎脱臼处死,取脑组织以1∶9(m/V)的比例加入预冻灭菌生理盐水,用手持匀浆机反复匀浆制成质量分数10%组织匀浆,4 ℃、3 000 r/min离心10 min,取上清液。按照试剂盒说明书所示,测定脑组织AchE、SOD、GSH-Px活力及Ach、MDA含量。 1.4 数据统计采用SPSS 20.0软件进行数据统计分析,所有结果表示为 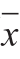 ±s,并采用单因素ANOVA和Duncan多重比较分析,P<0.05表明差异显著。 2.1.1 CTWF主要成分的定性分析  图1 标准品与CTWF色谱图
Fig.1 Chromatograms of reference substances and CTWF
通过比对标准品与样品的保留时间和液相紫外色谱图定性分析CTWF的主要成分[21]。如图1所示,CTWF包含绿原酸、黄诺马苷、儿茶素、花旗松素和马里苷,说明CTWF的主要活性成分由酚酸和黄酮类化合物组成,其中黄酮类化合物种类更多。同时,CTWF的色谱峰还有较多未被鉴定出来,仍需进一步研究。 2.1.2 CTWF主要成分的定量分析 表1 CTWF中各组分的保留时间、回归方程、相关系数和含量Table1 Retention times, linear equations, correlation coeff i cients and contents of CTWF  注:同列肩标小写字母不同表示差异显著(P<0.05),下同。 组分 保留时间/min 回归方程 相关系数 含量/(mg/g)绿原酸 20.18±0.12 y=24 279x-99 047 0.999 1 3.97±0.03d黄诺马苷 24.60±0.11 y=17 868x-72 736 0.9992 74.40±3.27b儿茶素 26.07±0.11 y=16 162x-53 422 0.9993 6.62±0.08d花旗松素 33.13±0.10 y=29 328x-75 521 0.9995 6.36±0.14d马里苷 34.37±0.10 y=10 549x-18 026 0.9995 53.25±1.31c总黄酮 y=0.012 6x-0.0061 0.9996 314.97±26.16a
通过外标法定量分析CTWF的主要成分[13]。如表1所示,CTWF中黄诺马苷含量最高,为(74.40±3.27)mg/g,其次是马里苷((5 3.2 5±1.3 1)m g/g)、儿茶素((6.6 2±0.0 8)m g/g)、花旗松素((6.3 6±0.1 4)m g/g)和绿原酸((3.97±0.03)mg/g),说明CTWF富含多酚,其中黄酮类化合物含量最高。同时,CTWF的总黄酮含量较高,为(314.97±26.16)mg/g。以上结果说明,CTWF发挥活性功能的物质基础主要是黄酮类化合物。 2.2 CTWF对小鼠体质量的影响表2 CTWF对D-半乳糖致衰老小鼠体质量的影响(n=12)
Table2 Effect of CTWF on body mass of D-galactose-induced aging mice (n= 12)  组别 第0天 第7天 第14天 第21天 第28天 第35天 第42天NC组 23.26±1.39a28.92±1.52ab31.39±1.69a33.80±2.23a35.43±2.27a37.03±1.86a38.93±1.68a MC组 23.87±1.09a27.73±2.50c28.28±1.75c31.24±2.29c33.57±1.94b34.77±1.52b35.72±2.08b PC组 24.03±1.02a28.83±1.93bc32.19±1.46a33.27±1.83ab35.17±2.08a37.33±1.95a38.33±1.92a CTWF-L组 23.76±1.02a27.84±2.06c30.27±2.92b31.95±2.15bc33.40±2.74b35.02±2.15b36.17±1.77ab CTWF-H组 23.99±0.81a29.76±1.48a31.19±1.99a33.58±2.23a35.83±2.33a37.15±2.31a38.91±1.74a
在衰老造模期间,小鼠体质量的增长变化情况是反映其生长发育及健康状况的重要指标之一[23]。如表2所示,各组小鼠之间初始体质量无显著差异(P>0.05),而随着实验的进行,各组小鼠体质量均有所增加。通过灌胃CTWF后,对各个时间点小鼠体质量数据进行统计分析表明:从第7天开始,MC组小鼠体质量显著低于NC组(P<0.05),并且差异随时间延长呈逐渐增大的趋势。从第7天开始,CTWF-L组小鼠体质量与NC组相比出现显著性差异(P<0.05)。整个实验过程中,PC、CTWF-H组小鼠体质量与NC组相比无显著性差异(P>0.05),说明CTWF对小鼠生长发育无不良影响。 2.3 CTWF对D-半乳糖致衰老小鼠学习记忆能力的影响2.3.1 CTWF对小鼠Morris水迷宫寻找平台潜伏期的影响  图2 CTWF对小鼠在训练过程中寻找平台潜伏期的影响
Fig.2 Effect of CTWF on escape latency of mice during training
Morris水迷宫定位航行实验结果如图2所示,随着训练次数的增加,各组小鼠找到隐蔽平台所需的时间(即潜伏期)逐渐缩短。从第2次训练开始,MC组小鼠潜伏期显著长于NC组(P<0.01),说明D-半乳糖致衰老小鼠空间学习记忆能力损伤,即造模成功。而PC组和CTWF-H组小鼠较MC组,其潜伏期在时段2~6期间均显著缩短(P<0.01,P<0.05),并在时段6时效果最明显(P<0.01)。CTWF-L对衰老模型小鼠学习记忆障碍有一定的改善作用(P<0.01,P<0.05),但效果比CTWF-H差。以上结果说明CTWF具有改善衰老模型小鼠空间学习记忆功能的作用。 2.3.2 CTWF对小鼠Morris穿越目标象限次数的影响  图3 CTWF对小鼠穿越目标象限次数的影响
Fig.3 Effect of CTWF on crossing number of mice during training
小鼠水迷宫训练6 次以后撤掉平台,测试各组小鼠的空间探索能力,从而反映小鼠的记忆保持能力。如图3所示,小鼠穿越目标象限次数具有组间差异。与NC组小鼠相比,MC组穿越次数显著减少(P<0.05),说明D-半乳糖致衰老模型小鼠空间位置记忆保持能力受损,即造模成功。PC组、CTWF-L组和CTWF-H组小鼠穿越目标象限的次数均比MC组显著增多(P<0.05),说明CTWF具有提升衰老模型小鼠记忆保持能力的作用。 2.4 CTWF对D-半乳糖致衰老小鼠脑组织胆碱能系统功能的影响表3 CTWF对衰老小鼠脑组织Ach含量及AchE活力的影响(n= 12)
Table3 Effect of CTWF on Ach content and AchE activity in brain tissues of aging mice (n= 12)  组别 Ach含量/(μg/mg pro)AchE活力/(μmol/mg pro)NC组 6.06±0.84a 1.24±0.19b MC组 3.88±0.41c 1.88±0.34a PC组 4.95±0.63ab 1.51±0.23ab CTWF-L组 4.16±0.40bc 1.78±0.27a CTWF-H组 5.41±0.83ab 1.44±0.15b
如表3所示,与NC组相比,D-半乳糖处理导致MC组小鼠脑组织中Ach含量显著降低(P<0.05),说明造模成功。与MC组相比,CTWF-H及VE处理组小鼠脑组织内Ach含量显著增加(P<0.05),而CTWF-L处理对脑组织中Ach含量有一定提升作用但不显著(P>0.05)。 此外,与NC组相比,MC组小鼠AchE活力显著增加(P<0.05),说明造模成功。与MC组相比,CTWF-H组小鼠脑组织AchE活力显著降低并恢复到正常水平(P<0.05)。CTWF-L和VE处理使得衰老小鼠脑组织中AchE活力呈降低趋势,但不显著(P>0.05)。以上结果说明CTWF的抗衰老作用与提升衰老小鼠脑组织胆碱能系统功能有关。 《厕所》里的哥哥莫里有惊恐障碍患者,之前在钢琴比赛的时候发作过一次,在妈妈去世之后更是严重到闭门不出。他在整理妈妈遗物时发现了缝纫机和布料,布料和小时候妈妈穿的长裙一模一样,于是他爱上了缝纫机和穿长裙,之后他竟然也可以穿着长裙弹琴,惊恐障碍症也没有发作。缝纫机是妈妈的遗物,长裙能让他想起了和妈妈在一起的童年时光。弟弟雷,他偏爱机器人模型到着魔,如果公寓着火,他会本能抢救机器人模型,痴迷的原因是因为雷的亲生妈妈去世之后,他哭得很伤心,莫里的妈妈给他买了机器模型,开心地瞬间忘记了亲生妈妈去世的事。 2.5 CTWF对D-半乳糖致衰老小鼠脑组织抗氧化指标的影响表1 CTWF对衰老小鼠脑组织SOD、GSH-Px活力及MDA含量的影响(n=12)
Table1 Effect of CTWF on SOD and GSH-Px activities and MDA content in brain tissues of aging mice (n= 12)  MDA含量/(nmol/mg pro)NC组 148.96±28.64a 228.91±40.44a 4.53±0.83c MC组 93.85±16.79c 127.76±32.37d 10.11±1.35a PC组 118.04±9.74bc 170.06±22.57bc 7.23±0.77b CTWF-L组 110.79±10.97bc 152.13±24.22c 8.02±1.19b CTWF-H组 131.90±17.69ab 187.11±31.27b 6.53±1.31b组别 SOD活力/(U/mg pro)GSH-Px活力/(U/mg pro)
如表4所示,与NC组相比,D-半乳糖诱导的衰老模型组小鼠脑组织中SOD和GSH-Px活力显著降低(P<0.05),MDA含量显著升高(P<0.05),说明造模成功。与MC组相比,PC组和CTWF-L组的SOD活力有所增加但不显著(P>0.05),CTWF-H组的SOD活力显著增加(P<0.05);与MC组相比,VE和CTWF药物处理均能显著增加衰老小鼠脑组织GSH-Px活力(P<0.05),且CTWF呈剂量依赖关系;与MC组相比,PC、CTWF-L和CTWF-H组小鼠脑组织MDA含量均显著降低(P<0.05),且CTWF呈剂量依赖关系。以上结果说明CTWF的抗衰老作用与提升衰老小鼠脑组织抗氧化酶活力和降低脂质过氧化相关。 3 讨 论小鼠长期注射D-半乳糖(50~500 mg/(kg·d),6~8 周)会导致其体内过量的活性氧(reactive oxygen species,ROS)堆积,抗氧化酶活力降低,线粒体和神经元损伤,并常伴随有认知障碍和学习记忆障碍,引起与自然衰老和正常脑老化相似的衰老现象[24-25]。因此,D-半乳糖注射已被逐渐接受为脑老化研究或抗衰老药理学研究中建立衰老模型的方法[23-26]。本研究选用昆明小鼠皮下注射D-半乳糖(300 mg/(kg·d))造模,造模时间为42 d。在造模期间,空白对照组和药物处理组小鼠精神状态良好、毛色光滑、皮肤有弹性、活动敏捷、食欲良好且体质量增长正常,模型组小鼠造模后出现精神萎靡、反应迟钝、皮肤松弛、毛色灰暗粗糙、脱毛炸毛现象且体质量增长缓慢;同时,D-半乳糖致衰老模型组小鼠的各评价指标均显著区别于正常组(P<0.05),表明构建衰老模型成功。 Morris水迷宫是由Richard Morris于1984年开发并逐步完善,用于研究脑损伤动物模型学习和记忆认知能力的一种行为学测试方法[27]。本研究采用Morris水迷宫评价CTWF对衰老小鼠学习记忆能力的影响。实验结果表明,衰老模型组小鼠的潜伏期在6 次训练过程中的缩短程度和撤去平台后穿越目标象限的次数均显著低于正常组(P<0.05),说明D-半乳糖造模导致小鼠学习记忆能力严重受损。通过药物处理干预后,VE阳性对照组和CTWF高、低剂量组小鼠较衰老模型组小鼠逃避潜伏期明显缩短(P<0.05,P<0.01),穿越目标象限的次数显著增加(P<0.05),表明CTWF可以起到改善衰老小鼠学习记忆功能障碍的作用,减缓脑老化。 人和动物的大脑学习记忆认知能力与胆碱能系统功能密切相关,脑组织中的Ach在调节学习记忆功能中发挥主要作用[1,4,28]。随着老化的发生,脑内Ach含量也随着减少,导致学习记忆能力的减退。AchE是反映胆碱能系统功能的一种特定蛋白酶,它能把突触间隙中的Ach降解使其含量降低[29]。因此,提高脑内Ach水平和降低AchE活力,从而提升脑内胆碱能系统功能可能是抗衰老和改善学习记忆能力的作用机理之一。本研究结果表明,模型组小鼠脑组织中的Ach含量和AchE活力均显著区别于正常组(P<0.05),说明D-半乳糖致衰老小鼠胆碱能系统功能降低。长期灌胃适当浓度的CTWF可提高衰老小鼠脑组织中Ach含量(P<0.05),降低AchE活力(P<0.05),表明CTWF可能通过改善胆碱能系统功能而发挥减缓脑老化的作用。 大量研究表明,氧化应激在脑老化、衰老相关性或神经退行性疾病的发病机制中发挥重要作用 [1,3,30]。随着衰老的加剧,体内ROS积聚,导致细胞大分子物质如DNA、蛋白质和细胞膜脂质发生氧化损伤[31]。脑组织具有高氧需求、高水平不饱和脂质和抗氧化防御机制相对缺乏的特点,更容易受到ROS的攻击,从而加剧脑老化[1]。因此,抗氧化干预可能是防治神经退行性疾病的重要途径。SOD和GSH-Px是体内重要的天然抗氧化酶,发挥机体抗氧化防御体系功能,可以有效抑制机体ROS的生成,间接反映机体清除自由基、免受氧化损伤的能力[32]。MDA是脂质过氧化的最终产物,其含量的高低直接反映机体脂质过氧化水平,代表组织受自由基损伤程度[33]。本研究结果表明,D-半乳糖致衰老小鼠脑内SOD、GSH-Px活力明显降低(P<0.05),MDA含量显著增加(P<0.05);CTWF灌胃处理能不同程度提高衰老小鼠脑组织SOD和GSH-Px活力,显著降低MDA含量(P<0.05),表明CTWF在清除氧自由基和抗氧化方面着发挥重要作用。 理、可行、适切的管理,这一过程涉及教师的培养、招聘、考核、培训、晋升的多个方面,应该是教师成长的全过程管理。 综上所述,CTWF具有明显改善D-半乳糖致衰老小鼠学习记忆障碍的作用,其可能由两方面共同发挥作用:一方面提高脑组织Ach含量和降低AchE活力,从而提升胆碱能系统功能;另一方面提高脑组织SOD、GSH-Px活力和降低MDA含量,从而减少自由基氧化损伤。 4 结 论本研究探讨了CTWF对D-半乳糖致衰老小鼠学习记忆能力的影响及其作用机制。结果表明CTWF对小鼠生长发育无不良影响;CTWF能显著改善D-半乳糖致衰老小鼠的空间探索能力及学习记忆能力(P<0.05,P<0.01);CTWF能有效改善衰老小鼠脑组织胆碱能系统功能(显著提高Ach含量,显著降低AchE活力(P<0.05)),显著抑制脑组织氧化应激水平(显著提高SOD和GSH-Px活力,显著降低MDA含量(P<0.05))。以上结果可以得出结论:CTWF具有明显改善D-半乳糖致衰老小鼠学习记忆障碍的作用,其机制可能与提高脑组织胆碱能系统功能和减少自由基损伤有关,同时说明昆仑雪菊可以作为一种潜在的抗衰老和益智食品,具有良好的应用开发前景。 参考文献: [1] ZHONG Shuzhi, GE Qinghua, QU Rong, et al. Paeonol attenuates neurotoxicity and ameliorates cognitive impairment induced by D-galactose in ICR mice[J]. Journal of the Neurological Sciences,2009, 277(1/2): 58-64. doi:10.1016/j.jns.2008.10.008. [2] BEKTAS A, SCHURMAN S H, SEN R, et al. Aging inflammation and the environment[J]. Experimental Gerontology, 2018, 105: 10-18.doi:10.1016/j.exger.2017.12.015. [3] 马莹娟, 尚玉莹, 王德杰, 等. 柿叶黄酮类化合物对D-半乳糖致衰老小鼠的抗炎抗氧化神经保护作用[J]. 复旦学报(医学版), 2015,42(1): 7-12; 30. doi:10.3969/j.issn.1672-8467.2015.01.002. [4] 明建, 曾凯芳, 吴素蕊, 等. 天麻多糖PGEB-3-H对东莨菪碱所致小鼠学习记忆障碍的影响[J]. 食品科学, 2010, 31(3): 246-249. [5] GUO Limin, ZHANG Wensheng, LI Shiming, et al. Chemical and nutraceutical properties of Coreopsis tinctoria[J]. Journal of Functional Foods, 2015, 13(4): 11-20. doi:10.1016/j.jff.2014.11.011. [6] 过利敏, 张平, 张谦, 等. 雪菊化学成分分析、提取、鉴定及其生物活性研究进展[J]. 食品科学, 2014, 35(7): 298-304. doi:10.7506/spkx1002-6630-201407058. [7] LAM S C, LIU Xin, CHEN Xianqiang, et al. Chemical characteristics of different partsof Coreopsis tinctoria in China using microwave-assisted extraction and high-performance liquid chromatography followed by chemometric analysis[J]. Journal of Separation Science,2016, 39(15): 2919-2927. doi:10.1002/jssc.201600365. [8] LI Yali, CHEN Xinmei, XUE Jie, et al. Flavonoids from Coreopsis tinctoria adjust lipid metabolism in hyperlipidemia animals by down-regulating adipose differentiation-related protein[J]. Lipids in Health and Disease, 2014, 13(1): 193-200. doi:10.1186/1476-511X-13-193. [9] DIAS T, MOTAFILIPE H, LIU B, et al. Recovery of oral glucose tolerance by Wistar rats after treatment with Coreopsis tinctoria infusion[J]. Phytotherapy Research, 2010, 24(5): 699-705. doi:10.1002/ptr.2998. [10] YAO Xincheng, GU Chengzhi, TIAN Liping, et al. Comparative study on the antioxidant activities of extracts of Coreopsis tinctoria fl owering tops from Kunlun Mountains, Xinjiang, north-western China[J]. Natural Product Research, 2016, 30(4): 429-432. doi:10.1080/14786419.2015.1015019. [11] WANG Wei, CHEN Wei, YANG Yingshi, et al. New phenolic compounds from Coreopsis tinctoria Nutt. and their antioxidant and angiotensin I-converting enzyme inhibitory activities[J]. Journal of Agricultural and Food Chemistry, 2015, 63(1): 200-207. doi:10.1021/jf504289g. [12] ZHANG Yuan, SHI Shepo, ZHAO Mingbo, et al. Coreosides A-D,C14-polyacetylene glycosides from the capitula of Coreopsis tinctoria and its anti-inf l ammatory activity against COX-2[J]. Fitoterapia, 2013,87(1): 93-97. doi:10.1016/j.f i tote.2013.03.024. [13] ZHI Qi, LI Yao, LI Fuhua, et al. The protective effect of polyphenols extracted from the buds of Coreopsis tinctoria against D-galactosamine/lipopolysaccharide-induced acute liver damage in mice[J].Journal of Functional Foods, 2018, 44: 201-208. doi:10.1016/j.jff.2018.03.019. [14] YANG Qiang, SUN Yuhua, ZHANG Li, et al. Antihypertensive effects of extract from fl ower buds of Coreopsis tinctoria on spontaneously hypertensive rats[J]. Chinese Herbal Medicines, 2014, 6(2):103-109. doi:10.1016/S1674-6384(14)60015-0. [15] SUN Yuhua, ZHAO Jun, JIN Hongtao, et al. Vasorelaxant effects of the extracts and some flavonoids from the buds of Coreopsis tinctoria[J]. Pharmaceutical Biology, 2013, 51(9): 1158-1164. doi:10.3109/13880209.2013.782320. [16] 沙爱龙, 吴瑛, 盛海燕, 等. 昆仑雪菊黄酮对衰老模型小鼠脑及脏器指数的影响[J]. 动物医学进展, 2013, 34(7): 66-68. doi:10.3969/j.issn.1007-5038.2013.07.014. [17] ZHANG Weixin, HAO Haiyan, SHA Ailong. Effects of the Coreopsis tinctoria extracts on anti-aging in the aging model mice[J]. Indian Journal of Animal Research, 2016, 50(5): 769-772. doi:10.18805/ijar.9630. [18] LI Ning, MENG Dali, PAN Ying, et al. Anti-neuroinflammatory and NQO1 inducing activity of natural phytochemicals from Coreopsis tinctoria[J]. Journal of Functional Foods, 2015, 17: 837-846.doi:10.1016/j.jff.2015.06.027. [19] 吴瑛, 刘天志, 袁守亮. 新疆高寒香菊总黄酮、多酚及水浸出物含量分析[J]. 食品科技, 2012, 37(8): 186-188; 192. doi:10.13684/j.cnki.spkj.2012.08.031. [20] 吴瑛, 王秀芳, 袁守亮. 响应面分析昆仑雪菊水溶性黄酮类化合物的提取工艺[J]. 食品科学, 2013, 34(6): 129-133. doi:10.7506/spkx1002-6630-201306028. [21] LIANG Qiang, CUI Jun, LI Hang, et al. Florets of sunf l ower (Helianthus annuus L.): potential new sources of dietary fi ber and phenolic acids[J]. Journal of Agricultural and Food Chemistry, 2013, 61(14):3435-3442. doi:10.1021/jf400569a. [22] SONG Jia, CHU Shuaishuai, CUI Yin, et al. Circadian rhythm resynchronization improved isoflurane-induced cognitive dysfunction in aged mice[J]. Experimental Neurology, 2018, 306: 45-54.doi:10.1016/j.expneurol.2018.04.009. [23] 陈燏, 刘洪吉, 尤倩倩, 等. 活性肽-N对D-半乳糖致衰老小鼠的作用效果[J]. 食品科学, 2018, 39(1): 178-184. doi:10.7506/spkx1002-6630-201801027. [24] 张丽梅, 程永强, 宋曙辉. 紫山药多糖对D-半乳糖衰老模型大鼠肝、脑的影响[J]. 食品科学, 2017, 38(13): 196-200. doi:10.7506/spkx1002-6630-201713032. [25] ZHOU Xuanxuan, YANG Qian, XIE Yanhua, et al. Protective effect of tetrahydroxystilbene glucoside against D-galactose induced aging process in mice[J]. Phytochemistry Letters, 2013, 6(3): 372-378.doi:10.1016/j.phytol.2013.05.002. [26] LI Jiejia, ZHU Qing, LU Yapeng, et al. Ligustilide prevents cognitive impairment and attenuates neurotoxicity in D-galactose induced aging mice brain[J]. Brain Research, 2015, 1595: 19-28. doi:10.1016/j.brainres.2014.10.012. [27] TUCKER L B, VELOSKY A G, MCCABE J T, et al. Applications of the Morris water maze in translational traumatic brain injury research[J]. Neuroscience and Biobehavioral Reviews, 2018, 88: 187-200. doi:10.1016/j.neubiorev.2018.03.010. [28] MOHAPEL P, LEANZA G, KOKAIA M, et al. Forebrain acetylcholine regulates adult hippocampal neurogenesis and learning[J]. Neurobiology of Aging, 2005, 26(6): 939-946. doi:10.1016/j.neurobiolaging.2004.07.015. [29] 赵玲, 刘丽, 张兰, 等. 不同时程的脑缺血对大鼠学习记忆功能及脑皮层乙酰胆碱酯酶活性的影响[J]. 中国比较医学杂志, 2006, 16(2):81-84. doi:10.3969/j.issn.1671-7856.2006.02.005. [30] GANDHI S, ABRAMOV A Y. Mechanism of oxidative stress in neurodegeneration[J]. Oxidative Medicine and Cellular Longevity, 2012,2012(3): 1-11. doi:10.1155/2012/428010. [31] HARIPRIYA D, SANGEETHA P, KANCHANA A, et al. Modulation of age-associated oxidative DNA damage in rat brain cerebral cortex,striatum and hippocampus by L-carnitine[J]. Experimental Gerontology, 2005, 40(3): 129-135. doi:10.1016/j.exger.2004.10.006. [32] 陈君, 杨光, 刘文群. 小鼠抗衰老实验及微生物抗衰老研究概况[J]. 中国酿造, 2011, 30(6): 13-16. doi:10.3969/j.issn.0254-5071.2011.06.004. [33] CUI Junjian, YUAN Jiangfeng, ZHANG Zhiqi, et al. Anti-oxidation activity of the crude polysaccharides isolated from Polygonum Cillinerve (Nakai) Ohwi in immunosuppressed mice[J]. Journal of Ethnopharmacology, 2010, 132(2): 512-517. doi:10.1016/j.jep.2010.08.052.
Water Soluble Flavonoids from Coreopsis tinctoria Flowers Improve Learning and Memory Ability in D-Galactose-Induced Aging Mice TIAN Yong1, ZHOU Du2, ZOU Shuangyi2, SUN Xingyu2, ZHI Qi1, LI Fuxiang1, MING Jian1,3,*
(1. College of Food Science, Southwest University, Chongqing 400715, China;2. High School Aff i liated to Southwest University, Chongqing 400715, China;3. Research Center of Food Storage & Logistics, Southwest University, Chongqing 400715, China) Abstract: Our aim in this study was to investigate the effects and mechanisms of water soluble fl avonoids from Coreopsis tinctoria fl owers (CTWF) on learning and memory ability in D-galactose-induced aging mice. Specif i c pathogen-free (SPF)Kunming mice were randomly divided into control, aging model, VE (50 mg/(kg·d)), and CTWF low- and high-dose groups(150 and 600 mg/(kg·d)). The mice in the control group were injected subcutaneously with normal saline while the mice in the other groups were successively injected with D-galactose (300 g/(kg·d)) for 42 days. At 1 hour after injection, the drug treatment groups were intragastrically administrated with VE and different dosage of CTWF while the mice from the control and model groups were administrated with an equal volume of normal saline. Learning and memory abilities were detected by Morris water maze test, and acetylcholinesterase (AchE), superoxide dismutase (SOD), and glutathione peroxidase(GSH-Px) activities, and acetylcholine (Ach) and malondialdehyde (MDA) contents in brain tissues were measured. Results showed that CTWF signif i cantly improved the learning and memory abilities of aging mice (P < 0.05), elevated SOD and GSH-Px activities and Ach content (P < 0.05), and reduced AchE activity and MDA content (P < 0.05). In conclusion,CTWF has a signif i cant effect on improving D-galactose-induced learning and memory disorders in mice, and its mechanism may be related to enhanced cholinergic system function and reduced free radical-induced damage in brain tissues of mice. Keywords: water soluble flavonoids from Coreopsis tinctoria flowers; learning and memory abilities; acetylcholine;superoxide dismutase; malondialdehyde
|  |Archiver|手机版|小黑屋|www.openhelp100.com
( 冀ICP备19026749号-1 )
|Archiver|手机版|小黑屋|www.openhelp100.com
( 冀ICP备19026749号-1 )