|
红松松仁蛋白肽的分离纯化及体外抗氧化和体内抗疲劳作用红松松仁蛋白肽的分离纯化及体外抗氧化和体内抗疲劳作用 郑元元,井 晶,王振宇*,彭方帅 (哈尔滨工业大学化工与化学学院,黑龙江 哈尔滨 150001) 摘 要: 以红松松仁蛋白为原料,采用胃蛋白酶和胰蛋白酶两步酶解制备松仁蛋白肽,并通过超滤、SP Sephadex C-25和Sephadex G-25凝胶层析进一步纯化,筛选具有抗氧化活性的松仁蛋白肽组分(PDII),测定PDII的分子质量分布,并对其进行体外抗氧化和体内抗疲劳实验。结果表明:PDII的分子质量分布范围为500~1 100 Da,该组分具有较强的抗氧化作用,不同剂量的PDII均能维持血糖水平、提高肝糖原的储糖能力,降低血清尿素氮、丙二醛、血乳酸的浓度,与空白组相比差异极显著(P<0.01),说明从红松松仁蛋白分离出的PDII既具有体外抗氧化活性,又具有体内抗疲劳作用。 关键词:红松松仁蛋白肽;两步酶解;分离纯化;抗氧化活性;抗疲劳作用 随着现代社会的快速发展和生活节奏的加快,人们的工作、学习压力越来越大,疲劳造成的身体不适和工作效率减退困扰着人们。最早由日本学者提出的“猝老死”是由于长期工作导致压力太大而引起的症状。通常情况下疲劳是短暂的,但少部分人具有持续的、令人虚弱的疲劳症状,其被称为“慢性疲劳综合征”,严重影响人们的身体健康和心理健康[1]。此外,研究发现氧化应激也会引起疲劳,氧化损伤会产生大量的自由基,促进疲劳的产生。根据Harman[2]的“自由基学说”,短暂的剧烈运动、长时间的压力以及长期劳累过度而得不到有效的缓解都会破坏机体的抗氧化活性和氧化系统的平衡,导致自由基大量堆积,从而限制运动的持续进行[3]。疲劳是一种复杂的症状[4],而氧化应激在疲劳的产生过程中扮演着重要角色,因此保护机体不受氧化伤害是预防疲劳的有效方法[5-6]。随着对抗疲劳研究的逐步深入,许多有效的抗疲劳产品被发现,包括动植物蛋白[7]、动植物蛋白肽[8-10]和乳源性蛋白肽[11-12]等。现代营养学研究表明,蛋白质通过消化道酶作用后不是全部以游离氨基酸的形式被吸收,而是部分以短肽的形式直接被身体吸收。因此,将大分子蛋白分解成小分子肽是近年来研究的重点。目前,制备肽的主要方法是酶解法,肽的分离纯化方法主要有超滤法、离子交换层析法、凝胶过滤层析法、制备型高效液相色谱法等。 红松(Pinus koraiensis Sieb. et Zucc.)主要产于我国东北长白山到小兴安岭一带,松仁是红松属植物种子成熟去皮后得到的果仁,含有丰富的蛋白质、氨基酸、不饱和脂肪酸、矿物质、维生素等,具有较高的营养价值[13]。目前,松仁的开发只局限于压榨松仁油,对其副产物松仁蛋白的开发较少,因此有必要对松仁蛋白进行深入探究。近年来,关于松仁蛋白活性肽的研究主要集中在其抗氧化活性、抗肿瘤活性、血管紧张素转化酶抑制活性等方面,但对松仁蛋白肽的抗疲劳功能还鲜有研究;因此对松仁蛋白进行深度开发具有重要的意义。 本研究是以红松松仁蛋白粉为原料,利用胃蛋白酶和胰蛋白酶两步酶解,再经超滤、离子交换树脂及凝胶过滤制备出松仁蛋白肽,并对其体外抗氧化活性和体内抗疲劳功能进行鉴定,为红松松仁资源的深度开发和研究提供理论参考。 北京艾捷默机器人系统有限公司是奥地利IGM机器人系统股份公司在中国设立的办事处, IGM是全球少数的同时拥有电弧、激光以及电子束技术的自动化焊接与切割系统的制造商,其与分布在各大洲拥有丰富经验的技术人员的20多个分支机构一道,IGM将自始至终地致力于其产品质量的不断提高。 1 材料与方法1.1 动物、材料与试剂昆明种清洁级雄性小鼠(18~22 g)购于哈尔滨医科大学第二附属医院实验动物中心,许可证号:SCXK(黑)2002-0002。 西洋参(规格XYSDP)购自吉林省康象参茸有限公司,由黑龙江中医药大学教研室鉴定为西洋参;红松松仁购于黑龙江小兴安岭地区农户家中。 SP Sephadex C-25阳离子交换柱、Sephadex G-25阳离子交换柱、胃蛋白酶 美国Sigma公司;胰蛋白酶 无锡雪梅酶制剂有限公司;活性炭 天津市天大化学试剂厂;肝糖原试剂盒、血清尿素氮试剂盒、全血乳酸试剂盒、丙二醛试剂盒 南京建成生物工程研究所;其他试剂均为国产分析纯。 1.2 仪器与设备血糖仪 南京建成生物工程研究所;PB-10 pH计德国塞多利斯公司;LD5-2A离心机 北京医用离心机厂;FD-1真空冷冻干燥机 北京博医康实验仪器有限公司;UV-2100紫外分光光度计 上海尤尼柯有限公司;85-2数显恒温磁力搅拌器 温州市医疗电器厂;1100高效液相色谱仪 美国Agilent公司。 1.3 方法1.3.1 松仁蛋白的提取 松仁蛋白采用超声辅助水提法制备[14]。将红松松仁去壳及红衣,粉碎,过40 目筛后与石油醚以料液比1∶10混合脱脂,重复3 次,即得脱脂松仁粉。将脱脂松仁粉与蒸馏水以料液比1∶25混合,在500 W的超声功率下50 ℃超声100 min,4 000 r/min离心15 min取上清液,用1 mol/L HCl溶液调节pH值至4.6以沉淀蛋白,4 000 r/min离心20 min取沉淀,用蒸馏水充分冲洗,加1 mol/L NaOH溶液调节pH值至7.0,样品于-20 ℃预冻24 h后冷冻干燥,研磨后即得松仁蛋白。 1.3.2 松仁蛋白粗酶解物的制备 采用胃蛋白酶进行第1步水解,水解条件为:pH 2.5,水解温度37 ℃,加酶量5 000 U/g,水解时间2 h;采用胰蛋白酶进行第2步水解,水解条件为:pH 8.00,水解温度45 ℃,加酶量10 000 U/g,水解时间90 min。在此条件下制备的松仁蛋白粗酶解产物进行后续实验。 1.3.3 超滤 目前,经皮冠状动脉介入治疗是临床上较为常用的治疗冠心病的方法之一,治疗后患者心肌血流灌注可有效改善,使患者症状得快速缓解,不过,手术治疗并不能对动脉粥样硬化过程做出阻止,导致患者的远期预后情况比较差[1]。近年有研究发现,冠心病患者行经皮冠状动脉介入治疗后,冠心病危险因素会对患者预后情况产生一定的影响[2]。为进一步探索冠心病危险因素与患者治疗后预后的相关性,本研究回顾性分析了行经皮冠状动脉介入治疗患者的相关资料,现做出报道。 分别采用截留分子质量为3 kDa和10 kDa的超滤离心管进行分离,得到小于3 kDa、3~10 kDa、大于10 kDa的3 种分子质量的水解产物,分别收集、冻干保存并测定其抗氧化活性。 1.3.4 SP Sephadex C-25阳离子交换层析 或由于“神圣性”的消失,致唐代以后的人们渐遗忘,甚至不能理解“日”与“乌”的关系。而“金鸡”与“金乌”在外形上颇为相似,在相关图像的传衍过程中,本即容易产生混淆。另一方面,则由于在一般世俗大众的普遍认知中,“鸡”和太阳的关系更为密切。因为鸡有“啼晨”的特性,因此古人常认为是鸡唤来了太阳,所谓“雄鸡一唱天下白”。在《广东新语·天语》中记有这样一则故事: 将超滤得到的抗氧化活性最强的组分配制成20 mg/mL溶液,过0.22 μm水系滤膜,采用SP Sephadex C-25阳离子交换柱(1.6 cm×60 cm)进行分离,上样量1.5 mL,首先用pH 4.0的醋酸钠缓冲液平衡柱子,之后用不同浓度NaCl-醋酸钠缓冲液进行线性洗脱,流速为0.5 mL/min,于220 nm波长处测定吸光度并收集组分,将分离出的组分分别冷冻干燥,测定各个组分的抗氧化活性。 1.3.5 Sephadex G-25凝胶层析 将1.3.4节中抗氧化活性最强的组分配制成20 mg/mL溶液,过0.22 μm水系滤膜,采用Sephadex G-25凝胶层析柱(1.6 cm×60 cm)进行分离,上样量1.5 mL,以去离子水为洗脱液,流速为0.5 mL/min,于220 nm波长处测定吸光度并收集组分,将分离出的组分分别冻干,测定各个组分的抗氧化活性。 综上可知,《周易》的“象”即易象和某种简单的物象全然不同,一方面它是“道”的存在方式,具有神秘性、象征性、形上性等特征,另一方面又是人们把握“道”的方式,具有直观性特征。 1.3.6 松仁蛋白多肽分子质量分布的测定 采用凝胶渗透色谱(gel permeation chromatography,GPC)测定松仁蛋白多肽的分子质量范围,选用不同分子质量(98 400、65 000、23 700、10 250、6 100、1 100 Da)的聚乙二醇为标准品。色谱条件:流动相为0.05 mol/L磷酸盐缓冲液和0.05 mol/L NaCl溶液(pH 7.0),流速为0.5 mL/min,色谱柱为SRT SEC-300,进样量为100 μL,检测温度25 ℃,柱温25 ℃。 1.3.7 体外抗氧化活性的测定 羟自由基清除能力的测定参考Amarowicz等[15]的方法。1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力的测定参考Wang Bin等[16]的方法。 1.3.8 体内抗疲劳实验模型的建立 参考Zhao Yuqin[4]和Guo Hang[17]等的方法,将小鼠随机分为5 组,每组10 只,空白组小鼠给予生理盐水灌胃。西洋参是公认的抗疲劳物质,具有良好的抗疲劳作用[18-19],因此阳性组小鼠灌胃0.1 mg/g西洋参。其他3 组小鼠分别灌胃0.05、0.10 mg/g和0.20 mg/g松仁蛋白多肽(PDII组分),相应记为低、中、高剂量组。连续灌胃受试小鼠4 周,测定各指标水平。 1.3.9 测定指标 1.3.9.1 强迫游泳实验 环境约束下长江经济带投入效率的时空差异···················王琳玉 于丽英 (3,486) 小鼠在最后一次灌胃后休息30 min,每组5 只小鼠尾部负5%体质量的铅块,放入游泳池(水温(25±1)℃,水深不低于30 cm)。不断搅拌水以确保小鼠的持续运动,直到小鼠沉没超过10 s,不再浮出,认为其体力消耗尽而死亡。从游泳开始到小鼠死亡的时间记录为游泳力竭时间/min。 1.3.9.2 生理生化指标的测定 在最后一次灌胃后,小鼠休息30 min,各组其余5 只动物放入游泳池(水温(25±1)℃,水深不低于30 cm)。不断搅动水以确保小鼠的持续运动。游泳30 min后,将小鼠从池中取出并用纸巾擦干。从眼球取血样后,立即取出小鼠肝脏、脾脏和胸腺,用生理盐水反复漂洗,去除血液,剔除脂肪及结缔组织,滤纸吸去多余水分,称质量,其与体质量的比值即为脏器指数。将全血以3 500×g离心15 min以获得血清,并将收集的样品贮存在-80 ℃,保存期不超过1 个月。根据试剂盒说明书测定血乳酸、血清尿素氮、丙二醛浓度和肝糖原含量,使用血糖测定仪测定血糖浓度。 1.4 数据统计分析各组实验结果用 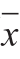 ±s表示,采用SPSS 13.0软件对各组数据进行单因素方差分析,P<0.05表示具有显著性差异,P<0.01表示具有极显著性差异。  图1 超滤各组分的抗氧化活性
Fig.1 Antioxidant activity of ultraf i ltration fractions
松仁蛋白粗酶解物经超滤分离得到3 个组分,分别记为P1(分子质量小于3 kDa)、P2(分子质量3~10 kDa)、P3(分子质量大于10 kDa)。由图1可知,P1组分的半抑制浓度(half maximal inhibitory concentration,IC50)低于其他组分,且极显著低于粗酶解物(P<0.01),抗氧化活性最强,因此,选择P1组分进行下一步纯化。 2.2 SP Sephadex C-25分离结果 图2 P1组分的SP Sephadex C-25分离洗脱曲线
Fig.2 Elution curve of fraction P1 on SP Sephadex C-25 column
由图2可知,P1组分经SP Sephadex C-25阳离子树脂分离后得到4 个组分,分别记为PA、PB、PC、PD。  图3 各洗脱组分的羟自由基和DPPH自由基清除能力
Fig.3 Hydroxyl and DPPH radical scavenging capacity of the eluted fractions
由图3可知,PD组分羟自由基和DPPH自由基的IC50低于其他组分,即清除能力均高于其他组分,即当NaCl浓度为0.10 mol/L时,洗脱组分的抗氧化活性最强。因此,选择PD组分进行下一步纯化。 2.3 Sephadex G-25分离结果 图1 PD组分的Sephadex G-25分离洗脱曲线
Fig.1 Elution curve of PD on Sephadex G-25 column
由图4可知,PD组分经Sephadex G-25分离后得到3 个组分,分别记为PDI、PDII、PDIII。  图5 各洗脱组分的羟自由基和DPPH自由基清除能力
Fig.5 Hydroxyl and DPPH radical scavenging capacity of the eluted fractions
如图5所示,PDII组分的羟自由基和DPPH自由基IC50低于其他组分,即清除能力最强,与粗酶解物相比具有极显著差异(P<0.01),因此,选择PDII组分进行后续研究。 2.4 松仁蛋白多肽分子质量分布分析 图6 松仁蛋白肽PDII的凝胶色谱
Fig.6 Gel fi ltration chromatogram of PDII
利用GPC进行分子质量分布曲线的绘制,标准分子质量(mp/Da)对数与保留体积(Vp/mL)的线性关系为:lg mp=12.980 0-2.673 5Vp+0.294 4Vp2-0.012 0Vp3,r2=0.999 548。如图6所示,数均分子质量(mn)为693 Da,重均分子质量(mw)为878 Da,分子质量分布范围主要为500~1 100 Da。 2.5 体内抗疲劳能力测定结果表1 各实验组小鼠的负重游泳时间
Table1 Weight-loaded swimming time of mice from all groups  注:与空白组相比,*.差异显著(P<0.05),**.差异极显著(P<0.01)。下同。 组别 负重游泳时间/min 游泳时间延长率/%空白组 14.63±1.10阳性组 24.68±4.04** 68.69低剂量组 17.17±1.46* 17.36中剂量组 22.60±3.34** 54.48高剂量组 27.17±2.91** 85.71
运动耐力是反映身体疲劳程度最直接和客观的指标。游泳疲劳模型是评估抗疲劳能力的运动实验模型,可以评估小鼠的耐力,具有很高的重现性[20-21]。运动耐力的提高是抗疲劳作用最有力的体现。在实验中,通过负重游泳实验研究了PDII的抗疲劳作用,游泳时间的长短反映疲劳程度。由表1可知,与空白组相比,松仁蛋白肽低、中、高剂量组和阳性组游泳时间均有所延长,低剂量组与空白组相比具有显著差异(P<0.05),中、高剂量组以及阳性组与空白组相比具有极显著差异(P<0.01)。高剂量组比阳性组小鼠游泳时间延长率增加了17.02%,表明PDII能起到延长小鼠的运动时间、提高其运动耐力的作用。 表2 各实验组小鼠的脏器指数
Table2 Organ indices of mice from all groups  胸腺指数/(mg/g)空白组 51.43±6.50 2.52±0.54 2.23±0.26阳性组 55.57±3.26 3.39±0.83 2.48±0.32低剂量组 52.50±3.86 2.49±0.80 2.47±0.80中剂量组 56.61±4.77 2.75±0.71 3.06±0.40高剂量组 57.03±1.93 3.11±0.46 3.02±0.30组别 肝脏指数/(mg/g)脾脏指数/(mg/g)
小鼠体质量和各个器官的脏器指数增加或减少过快,都不利于小鼠的生长。肝脏、脾脏和胸腺分别是人体最重要的代谢和解毒器官、最大的淋巴器官和重要的免疫器官。由表2可知,小鼠在剧烈运动后,松仁蛋白肽高剂量组的肝脏指数、脾脏指数及胸腺指数与空白组相比都有所增加,但无显著性差异,说明松仁蛋白肽在一定程度上可以缓解小鼠的疲劳症状。 血糖是中枢神经系统能量供应的主要来源之一,也是红细胞能量供应的唯一来源。因此,维持血糖平衡对器官功能至关重要[22]。长时间的力竭运动导致大量碳水化合物的消耗,血糖浓度的下降直接影响到脑细胞的能量供应,导致大脑的活动减少和身体疲劳。肝糖原是由许多葡萄糖分子聚合而成的物质,葡萄糖聚合物以糖原的形式贮存于肝脏,当饥饿或运动时,可以将其分解成葡萄糖以维持血糖水平[23]。肝糖原的贮存及分解可直接影响运动能力和持续运动时间[24]。因此,血糖浓度和肝糖原含量可以较好地反映疲劳程度[25]。由表3可以看出,与空白组相比,松仁蛋白肽各剂量组血糖浓度和肝糖原含量显著提高,中、高剂量组小鼠血糖浓度分别为空白组的1.70 倍和2.04 倍,差异显著(P<0.05,P<0.01);中、高剂量组小鼠肝糖原含量分别为空白组的2.11 倍和2.20 倍,差异极显著(P<0.01)。结果表明,PDII可以提高小鼠体内肝糖原的储备能力,进而维持小鼠运动时的血糖浓度,延缓疲劳。 表3 各实验组小鼠的生理生化指标
Table3 Physiological and biochemical indexes of mice from all groups  乳酸浓度/(mmol/L)空白组 3.60±0.64 4.09±0.36 13.53±0.66 6.59±1.52 11.23±0.71阳性对照组 5.23±0.12* 8.35±0.24** 9.65±0.60** 3.47±0.50* 7.73±0.77**低剂量组 4.37±0.42 6.51±0.51* 11.65±1.20 5.64±0.94 9.45±0.73中剂量组 6.00±0.63* 8.46±0.29** 9.93±1.45** 3.70±1.27* 7.34±0.86**高剂量组 7.33±0.36** 8.78±0.29** 7.44±1.26** 2.80±0.13**6.66±0.59**组别 血糖浓度/(mmol/L)肝糖原含量/(mg/g)血清尿素氮浓度/(nmol/L)丙二醛浓度/(nmol/L)
当糖原储存不足时,蛋白质会被分解以提供能量。蛋白质分解产生氨基酸,进一步代谢产生NH3和CO2,导致肝脏中尿素的合成,并通过血液循环和肾脏将尿素排出体外[26-27]。在正常生理条件下,尿素的形成和排泄保持平衡。然而,在长时间运动时,为了满足能量需求,蛋白质的代谢显著增加,因此尿素水平显著上升,过量的尿素会在体内积累并对机体造成危害。血清尿素氮浓度能体现尿素水平的高低,并与运动耐力呈负相关[28]。丙二醛是细胞膜脂质的氧化产物,被认为是脂质过氧化的指标[29],在疲劳状态下,丙二醛浓度升高[30]。另外,高强度或长时间运动会增加肌肉的氧气消耗,导致缺氧,加速糖酵解,并产生大量的酸性物质,如乳酸。这些变化降低了肌肉的pH值和收缩性,改变了体内酸碱平衡,并降低其运动能力[31-32]。因此,乳酸的积累也是身体疲劳的重要因素[33]。由表3可知,与空白组相比,中、高剂量松仁蛋白肽极显著降低血清尿素氮、丙二醛和乳酸浓度(P<0.01),具有较强的抗疲劳能力,表明PDII具有降低体内血清尿素氮、丙二醛和乳酸浓度的效果,可以起到延缓疲劳的作用。 3 结 论本研究利用两步酶解法获得具有抗氧化活性和抗疲劳活性的酶解产物。通过超滤、SP Sephadex C-25、Sephadex G-25分离得到组分PDII,对组分PDII分子质量分布进行测定,最终鉴定出PDII的分子质量分布范围为500~1 100 Da。该组分的羟自由基和DPPH自由基清除能力较强,并且其低、中、高剂量都有维持血糖浓度、提高肝糖原的储备能力和降低血清尿素氮、丙二醛和乳酸浓度的作用,中、高剂量的PDII具有显著的抗疲劳作用。 参考文献: [1] AOI W, NAITO Y, YOSHIKAWA T. Exercise and functional foods[J].Nutrition Journal, 2006, 5(1): 1-8. doi:10.1186/1475-2891-5-15. [2] HARMAN D. Aging: a theory based on free radical and radiation chemistry[J]. Journal of Gerontology, 1956, 11(3): 298-300.doi:10.1093/geronj/11.3.298. [3] ATAMANIUK J, VIDOTTO C, TSCHAN H, et al. Increased concentrations of cell-free plasma DNA after exhaustive exercise[J].Clinical Chemistry, 2004, 50(9): 1668-1670. doi:10.1373/clinchem.2004.034553. [4] ZHAO Yuqin, ZENG Li, YANG Zuisu, et al. Anti-fatigue effect by peptide fraction from protein hydrolysate of croceine croaker(Pseudosciaena crocea) swim bladder through inhibiting the oxidative reactions including DNA damage[J]. Marine Drugs, 2016, 14(12): 221.doi:10.3390/md14120221. [5] ELLIOTT J, LAL S. Blood pressure, sleep quality and fatigue in shift working police officers: effects of a twelve hour roster system on cardiovascular and sleep health[J]. International Journal of Environmental Research and Public Health, 2016, 13(2): 1-8.doi:10.3390/ijerph13020172. [6] TRUDEL X, BRISSON C, MILOT A, et al. Effort-reward imbalance at work and 5-year changes in blood pressure: the mediating effect of changes in body mass index among 1 400 white-collar workers[J].International Archives of Occupational and Environmental Health,2016, 89(8): 1229-1238. doi:10.1007/s00420-016-1159-x. [7] QI B, LIU L, ZHANG H, et al. Anti-fatigue effects of proteins isolated from Panax quinquefolium[J]. Journal of Ethnopharmacology, 2014,153(2): 430-434. doi:10.1016/j.jep.2014.02.045. [8] GUO Z B, LIN D Q, GUO J J, et al. In Vitro antioxidant activity and in vivo anti-fatigue effect of sea horse (Hippocampus) peptides[J].Molecules, 2017, 22(3): 482. doi:10.3390/molecules22030482. [9] XU J J, LI Y Y, REGENSTEIN J, et al. In vitro and in vivo antioxidation and anti-fatigue effect of monkf i sh liver hydrolysate[J]. Food Bioscience, 2017, 18: 9-14. doi:10.1016/j.fbio.2017.03.002. [10] ZHENG Z Q, YANG X X, LIU J, et al. Effects of wheat peptide supplementation on anti-fatigue and immunoregulation during incremental swimming exercise in rats[J]. RSC Advances, 2017, 7(69):43345-43355. doi:10.1039/C7RA07860A. [11] PAN D D, GUO Y X, JIANG X Y. Anti-fatigue and antioxidative activities of peptides isolated from milk proteins[J]. Journal of Food Biochemistry, 2011, 35(4): 1130-1144. doi:10.1111/j.1745-4514.2010.00440.x. [12] SUN S G, NIU H H, YANG T, et al. Antioxidant and anti-fatigue activities of egg white peptides prepared by pepsin digestion[J].Journal of the Science of Food and Agriculture, 2014, 94(15): 3195-3200. doi:10.1002/jsfa.6671. [13] 徐鑫, 毛文东, 刘国艳, 等. 松仁营养成分及松子油理化性质和活性成分分析[J]. 营养学报, 2014, 36(1): 99-101. [14] 赵玉红, 李莉. 超声波辅助提取松仁蛋白的工艺研究[J]. 中国林副特产, 2008(1): 6-8; 90. doi:10.3969/j.issn.1001-6902.2008.01.003. [15] AMAROWICZ R, NACZK M, SHAHIDI F. Antioxidant activity of various fractions of non-tannin phenolics of canola hulls[J].Journal of Agricultural and Food Chemistry, 2000, 48(7): 2755-2759.doi:10.1021/jf9911601. [16] WANG Bin, WANG Yumei, CHI Changfeng, et al. Isolation and characterization of collagen and antioxidant collagen peptides from scales of croceine croaker (Pseudosciaena crocea)[J]. Marine Drugs,2013, 11(11): 4641-4661. doi:10.3390/md11114641. [17] GUO Hang, KOUZUMA Y, YONEKURA M. Structures and properties of antioxidative peptides derived from royal jelly protein[J].Food Chemistry, 2009, 113(1): 238-245. doi:10.1016/j.foodchem.2008.06.081. [18] HARTZ A J, BENTLER S, NOYES R, et al. Randomized controlled trial of Siberian ginseng for chronic fatigue[J]. Psychological Medicine, 2004, 34(1): 51-61. doi:10.1017/S0033291703008791. [19] BARTON D L, SOORI G S, BAUER B A, et al. Pilot study of Panax quinquefolius (American ginseng) to improve cancer-related fatigue:a randomized, double-blind, dose-finding evaluation: NCCTG trial N03CA[J]. Supportive Care in Cancer, 2010, 18(2): 179-187.doi:10.1007/s00520-009-0642-2. [20] JIANG D Q, GUO Y, XU D H, et al. Antioxidant and anti-fatigue effects of anthocyanins of mulberry juice purification (MJP) and mulberry marc purif i cation (MMP) from different varieties mulberry fruit in China[J]. Food and Chemical Toxicology, 2013, 59: 1-7.doi:10.1016/j.fct.2013.05.023. [21] YOU L J, ZHAO M M, REGENSTEIN J M, et al. In vitro antioxidant activity and in vivo anti-fatigue effect of loach(Misgurnus anguillicaudatus) peptides prepared by papain digestion[J]. Food Chemistry, 2011, 124(1): 188-194. doi:10.1016/j.foodchem.2010.06.007. [22] WU J L, WU Q P, HUANG J M, et al. Effects of L-malate on physical stamina and activities of enzymes related to the malate-aspartate shuttle in liver of mice[J]. Physiological Research, 2007, 56(2):213-220. doi:10.1016/S0273-1177(97)00035-5. [23] JIA J M, WU C F. Antifatigue activity of tissue culture extracts of Saussurea involucrata[J]. Pharmaceutical Biology, 2008, 46(6):433-436. doi:10.1080/13880200802055909. [24] JUNG K, HAN D, KWON E, et al. Antifatigue effect of Rubus coreanus Miquel extract in mice[J]. Journal of Medicinal Food, 2007,10(4): 689-693. doi:10.1089/jmf.2006.006. [25] WANG J J, SHIEH M J, KUO S L, et al. Effect of red mold rice on antifatigue and exercise-related changes in lipid peroxidation in endurance exercise[J]. Applied Microbiology and Biotechnology,2006, 70(2): 247-253. doi:10.1007/s00253-005-0051-5. [26] LI X, ZHANG H, XU H. Analysis of chemical components of shiitake polysaccharides and its anti-fatigue effect under vibration[J].International Journal of Biological Macromolecules, 2009, 45(4): 377-380. doi:10.1016/j.ijbiomac.2009.07.005. [27] WANG L, ZHANG H L, LU R, et al. The decapeptide CMS001 enhances swimming endurance in mice[J]. Peptides, 2008, 29(7):1176-1182. doi:10.1016/j.peptides.2008.03.004. [28] ZHANG Y, YAO X B, BAO B L, et al. Anti-fatigue activity of a triterpenoid-rich extract from Chinese bamboo shavings (Caulis bamfusae in taeniam)[J]. Phytotherapy Research, 2006, 20(10):872-876. doi:10.1002/ptr.1965. [29] BAGIS S, TAMER L, SAHIN G, et al. Free radicals and antioxidants in primary fibromyalgia: an oxidative stress disorder?[J].Rheumatology International, 2005, 25(3): 188-190. doi:10.1007/s00296-003-0427-8. [30] BAO L, CAI X X, WANG J B, et al. Anti-fatigue effects of small molecule oligopeptides isolated from Panax ginseng C. A. meyer in mice[J]. Nutrients, 2016, 8(12): 1-11. doi:10.3390/nu8120807. [31] CAIRNS S P. Lactic acid and exercise performance: culprit or friend?[J]. Sports Medicine, 2006, 36(4): 279-291.doi:10.2165/00007256-200636040-00001. [32] KIM N H, MOON P D, PAK S C, et al. Anti-fatigue effect of Zizania caudiflora (Turczaninow) Nakai.[J]. American Journal of Chinese Medicine, 2012, 40(1): 111-120. doi:10.1142/S0192415X12500097. [33] WANG J J, SHIEH M J, KUO S L, et al. Effect of red mold rice on antifatigue and exercise-related changes in lipid peroxidation in endurance exercise[J]. Applied Microbiology and Biotechnology,2006, 70(2): 247-253. doi:10.1007/s00253-005-0051-5.
Isolation, Purif i cation and in Vitro Antioxidant and in Vivo Antifatigue Activity of a Peptide Derived from Pine Nut Kernels (Pinus koraiensis Sieb. et Zucc.) ZHENG Yuanyuan, JING Jing, WANG Zhenyu*, PENG Fangshuai
(School of Chemistry and Chemical Engineering, Harbin Institute of Technology, Harbin 150001, China) Abstract: An antioxidant peptide named PDII was purif i ed by sequential ultraf i ltration and SP Sephadex C-25 and Sephadex G-25 chromatography from the protein hydrolysate prepared by sequential enzymatic hydrolysis of pine nut kernels (Pinus koraiensis Sieb. et Zucc.) with pepsin and trypsin. The molecular mass distribution of PDII was determined and its in vitro antioxidant and in vivo antifatigue effect were evaluated. The results showed that the molecular mass of PDII was distributed in the range of 500-1 100 Da, and that it had a strong antioxidant effect. PDII at all investigated doses could maintain normal blood glucose level, increase glycogen storage capacity and decrease serum urea nitrogen and malondialdehyde and blood lactate acid; there results were statistically signif i cant compared with the blank group (P < 0.01), indicating that PDII had both antioxidant activity in vitro and anti-fatigue effect in vivo. Keywords: peptide derived from pine nut kernels; two-step enzymatic hydrolysis; isolation and purif i cation; antioxidant activity; antifatigue effect
|  |Archiver|手机版|小黑屋|www.openhelp100.com
( 冀ICP备19026749号-1 )
|Archiver|手机版|小黑屋|www.openhelp100.com
( 冀ICP备19026749号-1 )