|
饲养方式对苏尼特羊肌内脂肪沉积途径AMPK-ACC-CPT1通路和肉品品质的影响饲养方式对苏尼特羊肌内脂肪沉积途径AMPK-ACC-CPT1通路和肉品品质的影响 袁 倩,王 宇,苏 琳,罗玉龙,苏日娜,赵丽华,靳 烨* (内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018) 摘 要: 以放牧和舍饲两种饲养条件下12 月龄苏尼特羊股二头肌为实验材料,利用酶联免疫吸附测定法和实时荧光定量聚合酶链式反应法对肌内脂肪沉积动态平衡中脂肪酸β氧化一磷酸腺苷激活蛋白激酶(AMP-activated protein kinase,AMPK)-乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)-肉毒碱脂酰转移酶1(carnitine palmitoyltransferase,CPT1)通路所涉及的相关酶活力和质量浓度、相关基因mRNA表达量及肉品品质等指标进行测定,研究不同饲养方式对AMPK-ACC-CPT1信号通路相关指标、肌内脂肪含量及肉品品质产生的影响。结果表明:放牧饲养组羊股二头肌AMPK质量浓度、AMPK活力、CPT1质量浓度、AMPK mRNA表达量、亮度、黄度和剪切力显著大于舍饲饲养组(P<0.05);放牧饲养组羊股二头肌ACC活力、ACC mRNA表达量、肌内脂肪含量显著低于舍饲饲养组(P<0.05)。由此可见,放牧饲养可以一定程度上激活AMPK-ACC-CPT1通路,从而减少肌内脂肪沉积,增加羊肉亮度和黄度,降低嫩度,进而影响肉品品质。 关键词:饲养方式;苏尼特羊;一磷酸腺苷激活蛋白激酶;脂肪酸β氧化;肉品品质 苏尼特羊肉具有蛋白质和矿物质等营养成分含量高、脂肪酸分布合理等诸多优点[1]。传统放牧苏尼特羊因其肉质鲜美备受关注,近些年由于草场环境恶化导致其肉质下降。因此,寻找能够改善肉品品质的饲养方式和其他改善途径迫在眉睫。我国绵羊饲养方式主要有舍饲饲养、放牧加舍饲育肥饲养、放牧饲养3 种方式。如果从羊肉的风味和蛋白质、还原糖、矿物质等营养成分含量来考虑,放牧饲养一般优于舍饲饲养[2]。但是,过度放牧使草场条件变差,从而使育肥效果变差、出栏时间加长、羊肉产量减少,降低了经济效益[3]。而放牧结合舍饲饲养则可通过人工营养搭配,调控肌内脂肪(intramuscular fat,IMF)含量。营养水平对IMF含量的影响最为明显,营养水平高能增加肌内脂肪沉积水平,适当含量的肌内脂肪使肉的横切面呈大理石状,可以使肉柔软多汁、口感细嫩,并且可以改善肉及肉制品的保水性、嫩度、风味和质地[4]。吉帅等的研究表明,舍饲和半舍饲饲养可以降低羊肉膻味,其在改变羊肉感官品质的同时可以产生较好的嫩度和脂肪香味[5]。还有研究表明在放牧饲养条件下,动物可以从牧草中摄入较多的维生素(VA、VC、VE等)和多不饱和脂肪酸,以及具有抗氧化活性的矿物质等,从而影响肉品品质[6]。Akin等在不同饲养方式对Damascus羊胴体品质和肉品品质影响的研究中指出,羊所食牧草和饲料中VE含量不同导致羊肉脂肪抗氧化性能不同,进而导致肉品品质不同[7]。Priolo等的研究表明舍饲饲养羊肌肉更加柔软多汁,其保水性更好[8]。 一磷酸腺苷激活蛋白激酶(AMP-activated protein kinase,AMPK)可以通过调节动物糖代谢、脂代谢和蛋白质代谢等机体代谢影响肉品品质[9-13]。目前为止,关于AMPK表达对肉品品质影响的研究大多集中在糖代谢途径中。马晓冰研究了饲养方式对宰后苏尼特羊肉AMPK、糖酵解及肉品品质的影响,结果表明AMPK活化后能够提高己糖激酶的活力,加速糖酵解进程,导致乳酸含量增加。乳酸含量是影响宰后肌肉pH值的重要因素,进而会影响羊肉品质[14]。AMPK通过对脂肪代谢的调控来影响肉品品质,其主要是通过调控脂肪代谢相关基因和酶的表达影响肌内脂肪沉积来实现的,目前对这方面的研究较少。饮食、运动、温度等因素都可以激活AMPK,活化的AMPK抑制乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC),导致丙二酸单酰辅酶A含量减少,减弱了对肉毒碱脂酰转移酶1(carnitine palmitoyltransferase,CPT1)的抑制作用,促进脂肪酸进入线粒体进行氧化分解[13,15],从而使脂肪沉积减少、嫩度降低,进而影响肉品品质。因此,本实验就不同饲养方式对AMPK-ACC-CPT1信号通路的影响进行研究,进而研究AMPK在蛋白水平和基因水平对脂肪代谢的调节、IMF含量及肉品品质的影响,旨在为通过调控AMPK活力改善肉品品质提供理论依据。 1 材料与方法1.1 材料与试剂12 月龄健康无病放牧和舍饲饲养苏尼特羊各12 只,公母各半,由内蒙古乌拉特中旗育种园区提供。 RNAiso Plus试剂、Premix Taq Version2.0(loading dye mix)预混液、PrimeScript RT reagent试剂盒、SYBR Premix Ex Taq II试剂盒、6×loading buffer、Marker DL2000 大连宝生物工程有限公司;RNase-free水北京天根生物技术有限责任公司;焦碳酸二乙酯(diethy pyrocarbonate,DEPC) 美国Intrivogen公司;核酸染料 北京百泰克生物技术有限公司;绵羊AMPK酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒、绵羊ACC ELISA试剂盒、绵羊CPT1 ELISA试剂盒、绵羊p-AMPK ELISA试剂盒、绵羊p-ACC ELISA试剂盒 南京建成生物工程研究所有限公司;磷酸盐缓冲液(phosphate buffered saline,PBS) 北京eBio-top技术有限责任公司。 给身体健康的宝宝应用任何诸如“丙种球蛋白”之类的免疫增强药物都会扰乱宝宝正常的免疫功能发育,不但不能防病,反而会抑制宝宝自身的免疫功能或者引发宝宝出现新的免疫紊乱性疾病,因此不要轻易给有正常免疫功能的宝宝服用免疫增强剂这类生物制品。 1.2 仪器与设备ZHJH-C1112C超净工作台 上海智城分析仪器制造有限公司;5430R低温台式冷冻离心机、移液枪 德国Eppendorf公司;BG-power5000型稳压稳流电泳仪、水平电泳槽 北京百晶生物技术有限公司;凝胶成像系统、CFX96实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;普通PCR仪 美国AB公司;H2500R-2高速冷冻离心机长沙湘仪离心机仪器有限公司;电子天平 北京赛多利斯仪器系统有限公司;pH-STAR型胴体直测式pH计德国MATTHAUS公司;制冰机 宁波格兰特制冷设备制造有限公司;快速混匀仪 常州国华电器有限公司;C-LM3B型数显式肌肉嫩度仪 东北农业大学工程学院;TC-P2A全自动测色色差计 北京奥依克光电仪器有限公司。 1.3 方法1.3.1 样品处理 张子翔:杭州是历史文化名城,又是南宋画院的所在地,历史上人才辈出、硕果累累。800多年前的临安府,南宋画院以制度周密、画风创新而云集天下艺术英才,为中国艺术史留下瑰丽画宝。在多少代画家的共同努力下,逐步形成了中国画的浙派艺术,影响着整个中国画坛。这样的创作精神和管理理念深深影响着杭州画院,1985年成立以来,积极进取、砥砺奋发,承袭了南宋画院优秀传统,造就了一支德艺双馨的艺术家队伍,创作出了一大批紧扣社会时代脉搏、记录杭城民生的优秀作品,在杭州乃至浙江的美术发展中发挥着独特而积极的作用。 选取12 月龄健康无病放牧和舍饲饲养苏尼特羊各12 只,公母各半。放牧饲养组羊白天放牧,晚上不予补饲,牧草种类主要以乌拉特中旗荒漠化草原典型牧草(包括芨芨草、蒙古葱、中间锦鸡儿、沙生冰草、碱韭等10余种)为主。舍饲饲养组羊模拟内蒙古限牧政策下的饲养模式,即前9 个月同放牧饲养组,后3 个月舍饲育肥。育肥阶段食用农区饲草料(玉米秸秆、葵盘粉、葵花籽皮等,同时补充玉米精料)。两组实验羊在共同放牧9 个月后平均体质量大致相同。12 个月宰后选取股二头肌,一部分进行肉品品质测定,另一部分分割成小块放入冻存管后投入液氮速冻,在-80 ℃冰箱保存,待测定酶活力和质量浓度以及相关基因mRNA表达量时使用。 1.3.2 AMPK、ACC、CPT1的活力与质量浓度的测定 酶的提取:在10 mL的离心管中加入2.7 mL冰冻的PBS,取冰冻的肌肉样品0.3 g(冰冻肌肉在-80 ℃保存)。在3 000 r/min下冰浴匀浆,每个样品匀浆2~3 次,每次1 min,然后将匀浆后的样品在4 ℃、4 000 r/min下离心15 min,将上清液分装入1.5 mL离心管待测定时使用。 乡村治理视角主要从土地相关问题与乡村治理之间关系出发,探讨土地流转之后,农民的生活和农业生产所发生的变化,及其对村庄治理结构所产生的影响[12]。如有研究认为,与土地流转这一过程相伴随的是,早期建立在血缘或地缘等基础之上的互惠机制被瓦解,乡村社会内部逐渐失去了行动者相互之间的权利义务关系[13],农村内部建立起来的社会秩序或地方性的行为规范也在政府推动的大规模土地流转中被解构[14]。也有研究认为,地方政府出于完成任务或是政绩的考虑,积极推动土地流转,在行政推动作用下,乡村社会中自然形成的非完全竞争市场被扭曲,由此加剧了农民与基层政府之间的紧张关系,进而影响乡村治理[15]。 酶活力和质量浓度的测定(以AMPK为例):采用生物素双抗体夹心ELISA法测定样品中AMPK的质量浓度。向预先包被了AMPK单克隆抗体的酶标孔中加入AMPK,温育后加入生物素标记的抗AMPK抗体,再与链酶亲和素-过氧化物酶结合,形成免疫复合物,经过温育和洗涤去除未结合的酶,然后加入试剂盒中底物A、B,产生蓝色,并在酸的作用下最终转化成黄色,其颜色深浅与样品中AMPK的质量浓度呈正相关。ACC、CPT1、p-AMPK、p-ACC质量浓度的测定方法同上。 测定流程为:准备试剂、样品和标准品→加入准备好的样品和标准品,37 ℃反应90 min→洗板2 次,加入生物素抗体工作液,37 ℃反应60 min→洗板3 次,加入亲和素-过氧化物酶复合工作液,37 ℃反应30 min→洗板5 次,加入TMB显色工作液,37 ℃避光反应30 min→加入TMB终止液→30 min之内读取OD值→计算样品和标准品待测因子质量浓度。 以上多个问句可直接互相“提示”,牵连互涉,或者显示某种思维的“痕迹”,有的是内心的矛盾,有的是层层递进,或者自问自答,以问答问。 1.3.3 实时荧光定量PCR测定 采用TRIzol法提取总RNA,采用琼脂糖凝胶法和紫外-分光光度计检测总RNA的完整性和质量浓度。cDNA采用反转录试剂盒制备,置于-20 ℃保存待用。目的基因和管家基因的引物参照NCBI中提供的序列进行设计(表1)。实时荧光定量PCR程序为:95 ℃、30 s;95 ℃、5 s,57 ℃、30 s,72 ℃、30 s,共35 个循环;72 ℃、10 min,4 ℃、24 h。按照SYBR Premix Ex Taq II试剂盒说明书中CFX96实时荧光定量PCR仪步骤操作。以AMPKα1、AMPKα2、ACC和CPT1作为实验基因,18S RNA作为管家基因,分别做3 个平行。 表1 实时荧光定量PCR引物序列
Table1 Primers used for relative quantif i cation by real time PCR  基因名称 GenBank登录号 上游引物序列(5’-3’)下游引物序列(5’-3’)产物长度/AMPKα1 XM_012156760 TCCGAAGTATTGATGATGA ACAGATGAGGTAAGAGAAG 154 AMPKα2 NM_001112816.1 CGGGTTGAAGAGATGGAAGC AATTCACCATCTGACATCATGTTAG 179 ACC XM_015098292 GCAACATCACATCCGTCCTCT GTCCATCACCACAGCCTTCAT 188 CPT1 NM_001009259 AGTGGGTTCCTCCTGCTACA CTGGTCAAGTGGCTGGTCTG 240 18S RNA XM_012112109GTGGTGTTGAGGAAAGCGGACA TGATCACACGTTCCACCTCGTC 79
1.3.4 肉品品质的测定 动物屠宰前禁食12 h、禁水2 h,屠宰后选择股二头肌进行肉品品质测定。pH值利用pH-STAR型胴体直测式pH计测定。在宰后45 min时测定初始pH值,记作pH0,静置排酸24 h时测定最终pH值,记作pH24[16]。将肉样修整成3 cm×3 cm×1 cm的形状,使用TC-P2A全自动测色色差仪测定肉品颜色[17],结果分别用亮度(L*)、红度(a*)和黄度(b*)表示。将肉样修整成2.5 cm×3 cm×5 cm大小的肉块,密封后置于75 ℃水浴锅中煮45 min,取出后待肉块变凉,顺着肌纤维方向将肉块修成大小为3 cm×1 cm×1 cm的条状,测定剪切力以表征其嫩度[18]。称取肉样30.0~50.0 g置于沸水中煮45 min,取出后置于室温自然冷却30~40 min,沥干水分再次称质量,以煮后质量与煮前质量比值的百分数表示熟肉率。IMF含量的测定采用索氏抽提法[19]。 1.4 数据统计分析实验结果用 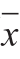 ±s表示,使用SPSS 19.0软件中单因素方差分析法进行显著性分析,P<0.05表示差异显著。 p-AMPK质量浓度代表AMPK的磷酸化程度,p-AMPK质量浓度/AMPK质量浓度表示AMPK的活力,其值越大表示AMPK活力越高;相似地,p-ACC质量浓度代表ACC的磷酸化程度,p-ACC质量浓度/ACC质量浓度代表ACC活力的倒数,其值越大表示ACC活力越低[20]。  图1 饲养方式对AMPK-ACC-CPT1通路相关酶质量浓度(A)和酶活力(B)的影响
Fig.1 Effects of feeding systems on enzyme concentrations (A) and activities (B) related to the AMPK-ACC-CPT1 pathway
由图1可知,放牧饲养组股二头肌的AMPK质量浓度、AMPK活力和CPT1质量浓度显著高于舍饲饲养组,ACC活力显著小于舍饲饲养组(P<0.05),而二者ACC质量浓度差异不显著(P>0.05)。Kido等的研究表明,运动使p-AMPKα蛋白表达与磷酸化水平和p-ACC蛋白表达水平显著增加,表示运动在蛋白水平上可以显著增加AMPK-ACC信号转导通路的表达[21],这与本研究结果一致。Yook等[22]对小鼠的实验和Granlund等[23]对猪的实验均证明运动在蛋白水平上可以激活AMPK,增加AMPK蛋白表达量。由于放牧饲养羊的运动量远多于舍饲饲养羊,所以放牧饲养条件下其股二头肌的AMPK质量浓度显著高于舍饲饲养。除此之外,也有研究表明放牧饲养羊所食牧草中不饱和脂肪酸含量较舍饲饲养组高,不饱和脂肪酸也有激活AMPK、促进AMPK表达的作用[24-25]。AMPK的激活对ACC的表达有抑制作用,ACC被抑制后会释放CPT1携带长链脂肪酸进入细胞膜,进而促进脂肪酸β氧化,从而减少脂肪沉积[26-27]。 例9(2016·宜宾):如图所示,已知光线在水面反射的光线OB,O为入射点。请作出其入射光线和进入水中的折射光线。 2.2 饲养方式对AMPK-ACC-CPT1通路相关基因mRNA表达量的影响2.2.1 总RNA提取结果  图2 总RNA提取结果
Fig.2 Electrophoresis of total RNA
由图2可知,28S、18S处条带清晰明亮,总RNA完整无降解。经紫外分光光度计检测其吸光度均在1.8~2.1之间,可知RNA纯度高,可用于后续反转录实验。 2.2.2 AMPK-ACC-CPT1通路相关基因mRNA表达量测定结果 表2 饲养方式对AMPK-ACC-CPT1通路相关基因mRNA表达量的影响
Table2 Effects of feeding systems on mRNA expression of genes related to the AMPK-ACC-CPT1 pathway  注:同行肩标小写字母不同表示差异显著(P<0.05);下同。 基因名称 放牧饲养 舍饲饲养AMPKα1 0.59±0.09a 0.27±0.01a AMPKα2 1.25±0.12a 0.38±0.01b ACC 0.54±0.01b 1.08±0.09a CPT1 43.58±5.21a 47.13±4.37a
由表2可知,放牧饲养组AMPKα2 mRNA表达量显著大于舍饲饲养组(P<0.05),而ACC mRNA表达量显著小于舍饲饲养组(P<0.05),AMPKα1、CPT1 mRNA表达量在两种饲养方式间无显著差异。张凯杰的研究表明,抗阻运动训练可以增加AMPKα1和AMPKα2的mRNA表达量[28]。梁俊芳在基因敲除对小鼠骨骼肌代谢的研究中发现,AMPKα2敲除后,AMPK活力显著下降,AMPK-ACC通路受阻[20]。Hu Xiyi等在限制饮食对鸡骨骼肌AMPK通路影响的研究中也发现,限制饮食可以激活骨骼肌AMPK,进而激活AMPK-ACC通路,且在基因水平上对调控此通路起主要作用的是AMPKα2[29],与本研究结果一致。由此可见,在基因水平上对AMPK-ACC-CPT1通路起主要调控作用的是AMPKα2。 2.3 饲养方式对IMF含量的影响 图3 不同饲养方式对IMF含量的影响
Fig.3 Effects of feeding systems on IMF content
由图3可知,放牧饲养苏尼特羊肉中的IMF含量显著低于舍饲饲养组(P<0.05)。这可能是由于运动可以激活AMPK-ACC-CPT1通路,促进脂肪酸氧化,减少脂肪的合成。张洁等在对AMPK在机体骨骼肌运动代谢适应方面的研究中得出结论,运动可以激活AMPK[30]。AMPK-ACC-CPT1通路激活后,脂肪沉积减少。Niu Yanmei等在对改善小鼠骨骼肌胰岛素抵抗的研究过程中也发现,有氧运动可以激活AMPKα-ACC-CPT1信号通路[31]。黄进宝在对茶多酚对肉鸡脂肪代谢的影响的研究中得出结论,AMPK-ACC-CPT1通路被激活后可以促进脂肪酸氧化,减少脂肪合成[32]。George等的研究表明舍饲饲养羊IMF含量显著高于放牧饲养羊[33],与本研究结果一致。 2.4 饲养方式对肉品品质的影响表3 饲养方式对肉品品质的影响
Table3 Effects of feeding systems on meat quality  指标 放牧饲养 舍饲饲养pH0 6.43±0.24a 6.53±0.28a pH24 5.71±0.08b 5.85±0.15a L* 29.79±0.67a 24.98±2.71b a* 20.73±1.76a 18.23±3.40a b* 6.18±2.14a 4.05±2.31b剪切力/g 64.21±5.24a 56.23±6.31b熟肉率/% 61.03±3.70a 61.30±3.02a
由表3可知,放牧饲养组羊股二头肌pH24显著低于舍饲饲养组(P<0.05)。对于色泽来说,股二头肌的L*值和b*值均为放牧饲养组显著高于舍饲饲养组(P<0.05)。肌肉亮度越低,肉表面反射的光越少,表明肉表面越干燥。Castellini[34]和张惠[35]等对草场散养肉鸡肌肉品质进行研究,发现由于散养组鸡肉的持水力降低,肌肉中大量水分到达肌肉表面,使得肌肉的亮度显著增加,这与本研究结果一致。本研究中放牧饲养组羊股二头肌黄度显著大于舍饲饲养组,此类的相关报道较少,其机理有待进一步研究。放牧饲养组羊股二头肌剪切力显著大于舍饲饲养组,表明放牧饲养组羊肉嫩度显著小于舍饲饲养组(P<0.05),这可能是由于放牧可以在一定程度上激活AMPK,同时激活AMPK-ACC-CPT1通路,促进脂肪酸氧化,抑制脂肪沉积,使得放牧饲养组羊肉IMF含量显著低于舍饲饲养组,由于IMF含量与嫩度呈正相关[19],最终使放牧饲养羊肉嫩度显著低于舍饲饲养。 3 结 论不同饲养方式对AMPK表达具有影响,放牧饲养较舍饲饲养可以促进AMPK表达,激活AMPK-ACC-CPT1通路,减少苏尼特羊肉脂肪沉积,进而影响其色泽、嫩度等诸多肉品品质指标。在当前草场载畜力不足的情况下,研究既能改善肉品品质又能满足草场可持续发展要求的新型限牧养殖模式具有重大意义。与此同时,通过调控AMPK的活力改变肌内脂肪沉积水平,进而改善不同饲养方式下的肉品品质,为未来养殖提供了新思路。 放牧饲养组羊股二头肌AMPK质量浓度、AMPK活力和CPT1质量浓度显著高于舍饲饲养组,ACC活力显著小于舍饲饲养组(P<0.05),说明放牧饲养可以在蛋白水平上激活AMPK-ACC-CPT1通路。放牧饲养组羊AMPKα2 mRNA表达量显著高于舍饲饲养组(P<0.05),ACC mRNA表达量显著低于舍饲饲养组(P<0.05),说明在基因表达水平上对AMPK-ACC-CPT1通路起主要调控作用的是AMPKα2亚基。放牧饲养苏尼特羊肉中的IMF含量显著低于舍饲饲养组(P<0.05),说明运动可以激活AMPK-ACC-CPT1通路,促进脂肪酸氧化,减少脂肪的合成。放牧饲养组羊股二头肌剪切力显著大于舍饲饲养组(P<0.05),表明放牧饲养组羊肉嫩度小于舍饲饲养组,说明放牧饲养可以一定程度上激活AMPK,同时激活AMPK-ACC-CPT1通路,促进脂肪酸氧化,抑制脂肪沉积,进而使得放牧饲养组羊肉IMF含量显著低于舍饲饲养组,最终使其嫩度显著低于舍饲饲养组,影响肉品品质。 参考文献: [1] 罗玉龙, 王柏辉, 靳志敏, 等. 两种饲养条件对苏尼特羊肉营养品质的影响[J]. 食品科学, 2016, 37(19): 227-231. doi:10.7506/spkx1002-6630-201619038. [2] VASTA V, D’ALESSANDRO A G, PRIOLO A, et al. Volatile compound profile of ewe’s milk and meat of their suckling lambs in relation to pasture vs. indoor feeding system[J]. Small Ruminant Research, 2012, 105(1/2/3): 16-21. doi:10.1016/j.smallrumres.2012.02.010. [3] 耿宁. 基于质量与效益提升的肉羊产业标准化研究[D]. 北京: 中国农业大学, 2015: 1-3. [4] WOOD J D, ENSER M, FISHER A V, et al. Fat deposition, fatty acid composition and meat quality: a review[J]. Meat Science, 2008, 78(4):343-358. doi:10.1016/j.meatsci.2007.07.019. [5] 吉帅, 侯鹏霞, 王洁, 等. 影响羊肉品品质的因素及改善措施[J]. 饲料研究, 2012(5): 12-14. doi:10.3969/j.issn.1002-2813.2012.05.004. [6] SCOLLAN N D, DHANOA M S, KIM E J, et al. Effects of diet and stage of development on partitioning of nutrients between fat and lean deposition in steers[J]. Meat Science, 2003, 76(2): 237-249. [7] AKIN Y, CAFER T A, SEMA A, et al. Damascus kids’ slaughter,carcass and meat quality traits in differentproduction systems using antioxidant supplementation[J]. Small Ruminant Research, 2016, 136:43-53. doi:10.1016/j.smallrumres.2016.01.002. [8] PRIOLO A, MICOL D, AGABRIEL J, et al. Effect of grass or concentrate feeding systems on lamb carcass and meat quality[J]. Meat Science, 2002, 62(2): 179-185. doi:10.1016/s0309-1740(01)00244-3. [9] 陈代文, 张克英. AMPK对动物营养代谢的调节作用[J]. 动物营养学报, 2002(3): 1-6. [10] EID H M, THONG F, NACHAR A, et al. Caffeic acid methyl and ethyl esters exert potential antidiabetic effects on glucose and lipid metabolism in cultured murine insulin-sensitive cells through mechanisms implicating activation of AMPK[J]. Pharmaceutical Biology, 2017, 55(1): 2026-2034. doi:10.1080/13880209.2017.1345952. [11] LI L Z, ZHANG T, YANG L, et al. Inhibition of lipolysis by ilexgenin A via AMPK activation contributes to the prevention of hepatic insulin resistance[J]. European Journal of Pharmacology, 2017, 813: 84-93.doi:10.1016/j.ejphar.2017.07.038. [12] FRYLINCK L, STRYDOM P E, WEBB E C, et al. Effect of South African beef production systems on post-mortem muscle energy status and meat quality[J]. Meat Science, 2013, 93(4): 827-837.doi:10.1016/j.meatsci.2012.11.047. [13] 王宇, 袁倩, 王柏辉, 等. 腺苷酸活化蛋白激酶活性及其级联效应对肉品品质的影响研究进展[J]. 食品科学, 2018, 39(17): 298-304.doi:10.7506/spkx1002-6630-201817047. [14] 马晓冰. 饲养方式对宰后苏尼特羊肉AMPK、糖酵解及肉品品质的影响[D]. 呼和浩特: 内蒙古农业大学, 2016: 36-28. [15] WITCZAK C A, SHAROFF C G, GOODYEAR L J, et al. AMP-activated protein kinase in skeletal muscle: from structure and localization to its role as a master regulator of cellular metabolism[J].Cellular and Molecular Life Sciences, 2008, 65(23): 3737-3755.doi:10.1007/s00018-008-8244-6. [16] 张宏博, 王贵印, 袁倩, 等. 巴美肉羊的食用品质[J]. 食品科学, 2013,34(19): 19-22. doi:10.7506/spkx1002-6630-201319005. [17] 李泽, 靳烨, 马霞. 不同贮藏温度下宰后羊肉的肉质变化及其影响因素[J]. 农业工程学报, 2010, 26(增刊 1): 338-342. [18] 靳烨, 南庆贤. 高压处理对牛肉感观性能与食用品质的影响[J]. 农业工程学报, 2004, 20(5): 196-199. [19] 尹靖东. 动物肌肉生物学与肉品科学[M]. 北京: 中国农业大学出版社, 2011: 22-25. [20] 梁俊芳. AMPKα亚基对小鼠骨骼肌生长发育及宰后糖酵解过程的影响[D]. 呼和浩特: 内蒙古农业大学, 2013: 47-48. [21] KIDO K, YOKOKAWA T, ATO S, et al. Effect of resistance exercise under conditions of reduced blood insulin on AMPKα Ser485/491 inhibitory phosphorylation and AMPK pathway activation[J].American Journal of Physiology Regulatory Integrative &Comparative Physiology, 2017, 313(2): R110-R119. doi:10.1152/ajpregu.00063.2017. [22] YOOK J S, CHO J Y. Treadmill exercise ameliorates the regulation of energy metabolism in skeletal muscle of NSE/PS2m-transgenic mice with Alzheimer’s disease[J]. Journal of Exercise Nutrition &Biochemistry, 2017, 21(1): 40-47. doi:10.20463/jenb.2017.0046. [23] GRANLUND A, JENSEN-WAERN M, ESSÉN-GUSTAVSSON B.The inf l uence of the PRKAG3 mutation on glycogen, enzyme activities and fi bre types in different skeletal muscles of exercise trained pigs[J].Acta Veterinaria Scandinavica, 2011, 53(1): 1-8. doi:10.1186/1751-0147-53-20. [24] GUELER G O, AKTUMSEK A. Effect of feeding regime on fatty acid composition and conjugated linoleic acid content of perirenal, omental and tail fat in Akkaraman lambs[J]. African Journal of Biotechnology,2011, 10(36): 7099-7108. [25] 任阳. 饱和与不饱和脂肪酸对猪肌纤维饲养组成的影响及其AMPK途径研究[D]. 杭州: 浙江大学, 2014: 71-77. [26] O’NEILL H M, LALLY J S, GALIC S, et al. AMPK phosphorylation of ACC2 is required for skeletal muscle fatty acid oxidation and insulin sensitivity in mice[J]. Diabetologia, 2014, 57(8): 1693-1702.doi:10.1007/s00125-014-3273-1. [27] NIU Y, YUAN H, FU L. Aerobic exercise’s reversal of insulin resistance by activating AMPKa-ACC-CPT1 signaling in the skeletal muscle of C57BL/6 mice[J]. International Journal of Sport Nutrition and Exercise Metabolism, 2010, 20(5): 370-380. doi:10.1123/ijsnem.20.5.370. [28] 张凯杰. 抗阻训练对老年小鼠肝脏脂代谢及其相关基因表达的影响[D]. 上海: 华东师范大学, 2013: 30-32. [29] HU Xiyi, LIU Lei, SONG Zhigang, et al. Effects of feed deprivation on the AMPK signaling pathway in skeletal muscle of broiler chickens[J]. Comparative Biochemistry and Physiology, Part B, 2016,191: 146-154. doi:10.1016/j.cbpb.2015.10.007. [30] 张洁, 傅力. AMPK在机体骨骼肌运动代谢适应方面的研究进展[J].生理科学进展, 2016, 47(5): 391-394. [31] NIU Yanmei, YUAN Hong, FU Li. Aerobic exercise’s reversal of insulin resistance by activating AMPK-ACC-CPT1 signaling in the skeletal muscle of C57BL/6 mice[J]. International Journal of Sport Nutrition & Exercise Metabolism, 2010, 20(5): 370-380.doi:10.1123/ijsnem.20.5.370. [32] 黄进宝. 茶多酚对肉鸡脂肪代谢的影响及分子机制研究[D]. 合肥:安徽农业大学, 2014: 62-64. [33] GEORGE Z, ELENI T. The effect of feeding systems on the characteristics of products from small ruminants[J]. Small Ruminant Research, 2011, 101(1): 140-149. doi:10.1016/j.smallrumres.2011.09.034. [34] CASTELLINI C, MUGNAI C, BOSCO A D. Effect of organic production system on broiler carcass and meat quality[J]. Meat Science, 2002, 60(3): 219-225. doi:10.1016/S0309-1740(01)00124-3. [35] 张惠, 闫俊书, 宦海林, 等. 放牧饲养对雪山草鸡屠宰性能及肉色的影响[J]. 南方农业学报, 2011, 42(6): 672-675. doi:10.3969/j.issn.2095-1191.2011.06.028.
Effects of Different Feeding Systems on Intramuscular Fat Deposition Pathway AMPK-ACC-CPT1 and Meat Quality in Sunit Lamb YUAN Qian, WANG Yu, SU Lin, LUO Yulong, SU Rina, ZHAO Lihua, JIN Ye*
(College of Food Science and Engineering, Inner Mongolia Agricultural University, Hohhot 010018, China) Abstract: In the present study, we assessed the effects of two different feeding systems on the activities and mRNA expression levels of enzymes involved in the AMP-activated protein kinase-acetyl-CoA carboxylase-carnitine palmitoyltransferase(AMPK-ACC-CPT1) pathway, fat content and meat quality in the Biceps femoris muscle of 12-month-old Sunit lambs. The enzyme activities were determined by enzyme-linked immunosorbent assay and gene expression was measured by real-time fluorescence quantitative polymerase chain reaction (PCR). The results showed that AMPK concentration and activity, AMPK mRNA expression, CPT1 concentration, brightness (L* value), yellowness (b* value) and shear force in the biceps femoris muscle of grazed lambs were signif i cantly higher than those in stall-fed lambs (P < 0.05),while the opposite was observed for ACC activity, ACC mRNA expression and intramuscular fat content (P < 0.05).Accordingly we concluded that grazing can activate the AMPK-ACC-CPT1 pathway to reduce intramuscular fat deposition,increase L* and b* values and decrease tenderness, consequently affecting lamb meat quality. Keywords: feeding systems; Sunit lamb; AMP-activated protein kinase; fatty acid β oxidation; meat quality
|  |Archiver|手机版|小黑屋|www.openhelp100.com
( 冀ICP备19026749号-1 )
|Archiver|手机版|小黑屋|www.openhelp100.com
( 冀ICP备19026749号-1 )