|
氨基酸缺乏对母犊牛生长和日粮养分消化代谢的影响氨基酸缺乏对母犊牛生长和日粮养分消化代谢的影响 孔凡林1,李媛1,唐梦琪2,马满鹏1,付彤2,刁其玉1,成思源1,屠焰1 (1中国农业科学院饲料研究所/奶牛营养学北京市重点实验室,北京 100081;2河南农业大学牧医工程学院,郑州 450000) 摘要:研究赖氨酸(Lys)、蛋氨酸(Met)和苏氨酸(Thr)缺乏对3-6月龄中国荷斯坦母犊牛生长和日粮养分消化代谢的影响,为生产中判断母犊牛氨基酸缺乏症提供依据,并对后续母犊牛氨基酸需要量的确定提供理论依据。【方法】 72头84日龄中国荷斯坦母犊牛,按体重和出生时间相近原则随机分为4个处理组,限量饲喂4种不同氨基酸模式的饲粮,分别为氨基酸平衡组(PC组)、赖氨酸扣除组(PC-Lys)、蛋氨酸扣除组(PC-Met)和苏氨酸扣除组(PC-Thr),氨基酸扣除量均为PC组的30%。试验期97d,其中预饲期7d,正试期90d。于正试期第1、30、60、90天测定犊牛体重、体尺和乳头长度;在132—138和173—179日龄每组分别选取6头健康犊牛进行2期消化代谢试验,收集粪、尿和饲料样品,测定营养物质表观消化率及氮代谢;正试期每天记录采食量。【结果】与饲喂氨基酸平衡饲粮的犊牛相比:(1)扣除Lys显著降低90—180日龄犊牛饲料转化效率(P<0.05),日增重(ADG)为各组最低(P>0.05);扣除Met和Thr对90—180日龄犊牛ADG和饲料转化效率没有显著影响(P>0.05);(2)扣除Lys或Thr显著降低犊牛粪便评分(P<0.05),但对腹泻率没有影响(P>0.05),以PC-Lys组腹泻率最高;3)扣除Lys、Met或Thr均不影响犊牛体尺(P>0.05),但扣除Lys后犊牛乳头长度增长率均低于PC组(P>0.05);4)扣除Lys、Met或Thr不影响日粮养分表观消化率(P>0.05),但扣除Lys显著降低173—179日龄犊牛氮利用率和氮生物学价值(P<0.05)。【结论】在本试验设定的氨基酸平衡饲粮基础上,扣除Lys对犊牛生长发育和氮代谢有不利影响,扣除Thr影响犊牛腹泻,扣除Met对犊牛无明显影响。 关键词:赖氨酸;蛋氨酸;苏氨酸;母犊牛;生长性能;氮代谢 0 引言【研究意义】断奶后犊牛机体发育迅速,消化方式正在由皱胃单一消化模式过渡到以瘤网胃为主的复胃混合消化模式,生理结构和饲喂方式的巨大改变使得到达小肠的氨基酸(AA)数量和种类发生巨变,此时营养的供给应及时满足犊牛体况生长和乳腺发育的需要,因营养摄入不足而导致的牛只体格和乳腺发育迟缓将直接影响后期泌乳牛的产奶量[1-2]。蛋白质是影响犊牛生长发育的重要营养素之一,可消化蛋白质的AA构成将影响犊牛吸收AA的效率[3],所以需重点关注该阶段犊牛AA供给的准确性。【前人研究进展】但NRC奶牛营养需要量(2001)[4]和NRC肉牛营养需要量(2016)[5]均未给出犊牛阶段的理想AA模式,近年来反刍动物AA的研究也多集中在泌乳牛和断奶前犊牛阶段,极少聚焦于断奶后犊牛,既缺乏探究断奶后犊牛AA需要量的研究,也未探究在AA缺乏时,断奶后犊牛在生长性能和日粮养分消化代谢上的变化。【本研究切入点】基于我国奶牛饲养过程中对断奶后犊牛饲养的粗放和断奶后犊牛健康培育具有的潜在价值,目前亟待明确断奶后犊牛在AA缺乏时的表观性状变化以及对内在日粮养分消化代谢的影响。【拟解决的关键问题】本试验参考前人得到的后备牛蛋氨酸(Met)需要量预测模型,借鉴同为生长阶段的猪适宜AA比例,依据部分扣除法[6-7],研究赖氨酸(Lys)、蛋氨酸和苏氨酸(Thr)缺乏对犊牛生长及日粮养分消化代谢的影响,一方面可以为后续断奶后犊牛阶段AA需要量的确定提供理论依据,另一方面可以为生产中判断断奶后犊牛AA是否缺乏提供判断依据。 1 材料与方法1.1 试验时间与地点试验于2018年3—6月在山东银香伟业有限公司第三牧场进行。 1.2 试验动物与设计选择72头平均日龄为(84±7)d、体重(101±11)kg的中国荷斯坦母犊牛,按日龄、体重相近原则随机分成4个处理组,每组18头。分别饲喂4种饲粮,对照组为设定的氨基酸平衡日粮(PC),其他3组分别从PC日粮中扣除30%的Lys(PC-Lys)、Met(PC-Met)和Thr(PC-Thr)。PC组饲粮中Met水平按照ZINN等[8]的后备牛Met需要量估测模型(METR=1.956+ 0.0292ADG[268-(29.4×0.0557BW0.75ADG1.097)/ADG]+ 0.112BW0.75)计算,其他氨基酸(Lys、Thr)水平以Met为基础,按照生长猪日粮适宜AA比例(Lys﹕Met﹕Thr = 100﹕33﹕65)[9]计算。根据上阶段犊牛BW和ADG,每30天调整一次AA添加量。 1.3 试验饲粮参照NRC(2001)[4]中150 kg生长母牛ADG为1 kg·d-1时的营养需要量配制饲粮,各组通过在饲粮中添加过瘤胃氨基酸以达到试验设计的要求,各处理组基础饲粮的原料组成和数量比例均一致,唯一差别在于Lys、Met和Thr添加量的不同。基础饲粮组成及营养水平见表1,各组饲粮中过瘤胃氨基酸产品的添加量和最终AA在饲粮中的占比见表2。 天然橡胶的生物合成是由一系列酶促反应构成,萜类物质(包括橡胶)合成的通用前体就是牻牛儿基牻牛儿基焦磷酸(GGPP),同时它也是聚异戊二烯类物质合成的起点[1]。GGPP的大量合成有利于乳管细胞中橡胶合成途径的激活以及橡胶合成途径下游的关键酶发挥作用,从而提高橡胶的合成速率[2]。 1.4 饲养管理犊牛单笼饲养,笼面积为5.7 m2,每30 d更换一次垫料。每天饲粮干物质饲喂量为犊牛体重的3%,分别于08:00、14:00和19:00饲喂,在第二天投料前对每头牛的剩料进行称重并记录。每2周根据采食情况和体况变化调整饲喂量,自由饮水。预饲期7 d,正试期90 d。 表1 基础饲粮组成及营养水平(干物质基础,%) Table 1 Composition and nutrient levels of basal diet (dry matter basis, %) 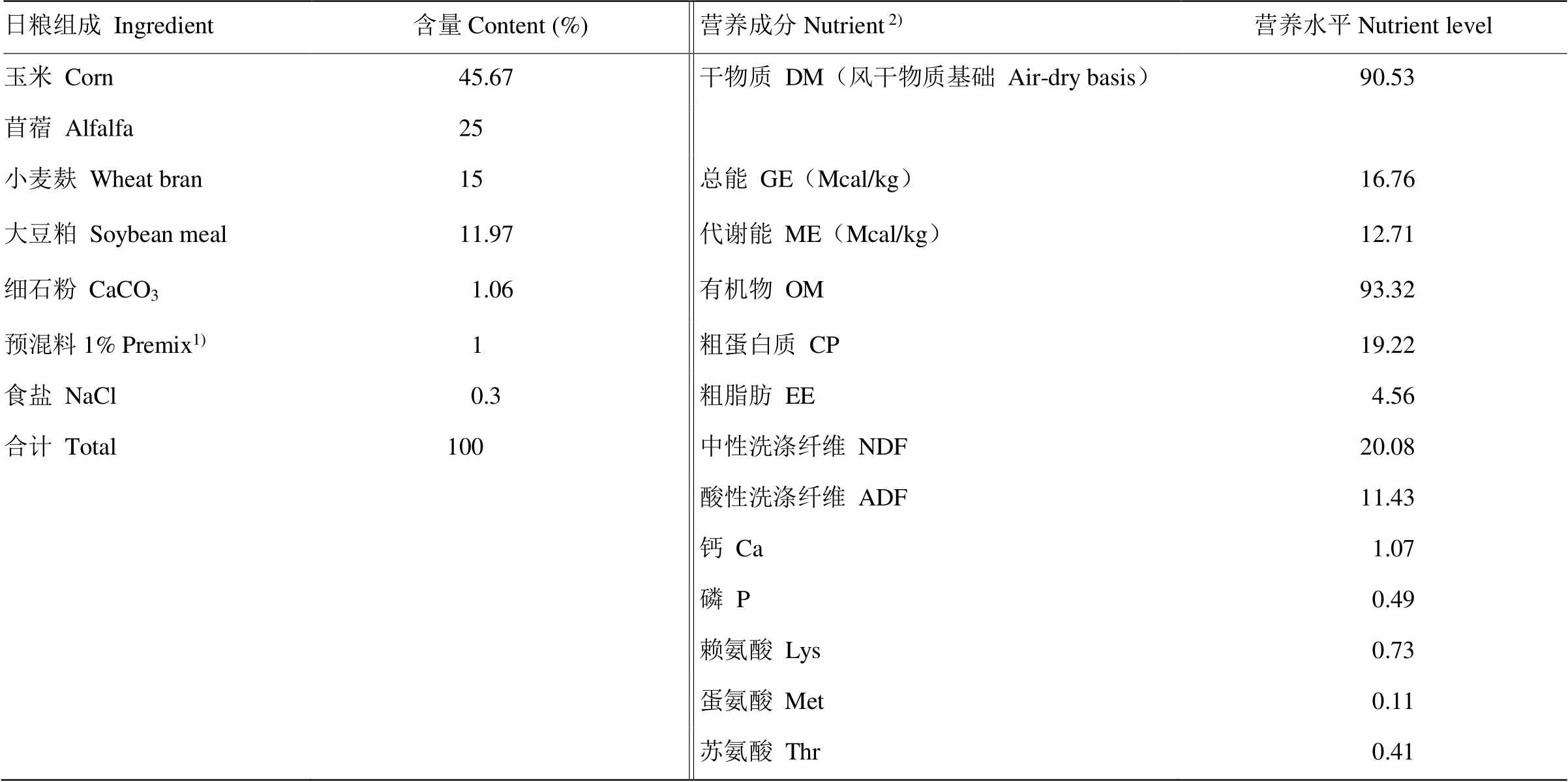 日粮组成Ingredient含量Content (%)营养成分Nutrient 2)营养水平Nutrient level 玉米Corn45.67干物质DM(风干物质基础Air-dry basis)90.53 苜蓿Alfalfa25 小麦麸Wheat bran15总能GE(Mcal/kg)16.76 大豆粕Soybean meal11.97代谢能ME(Mcal/kg)12.71 细石粉CaCO31.06有机物OM93.32 预混料1% Premix1)1粗蛋白质CP19.22 食盐NaCl0.3粗脂肪EE4.56 合计Total100中性洗涤纤维NDF20.08 酸性洗涤纤维ADF11.43 钙Ca1.07 磷P0.49 赖氨酸Lys0.73 蛋氨酸Met0.11 苏氨酸Thr0.41
1)预混料为每千克开食料提供The premix provided per kg of the starter diet: VA, 15000 IU; VD, 5000IU; VE, 50 mg; Fe, 90 mg; Cu, 12.5 mg; Mn, 30 mg; Zn, 90 mg; Se, 0.3 mg; I, 1.0 mg; Co, 0.3 mg 2)营养水平除代谢能外均为实测值,代谢能按照甲烷能占总能的6.5%计算[10] ME was a calculated value and others were measured values. Metabolic energy is calculated on the basis that methane energy accounts for 6.5% of total energy 表2 饲粮中过瘤胃氨基酸商品的添加量及氨基酸水平(干物质基础,%) Table 2 Dietary rumen-protected amino acid production and amino acid levels(dry matter basis, %)  项目Item组别Group PCPC-LysPC-MetPC-Thr 过瘤胃赖氨酸产品RPLys product1)1.680.421.681.68 过瘤胃蛋氨酸产品RPMet product2)1.321.320.771.32 过瘤胃苏氨酸产品RPThr product3)1.051.051.050.40 赖氨酸Lys1.210.851.211.21 蛋氨酸Met0.400.400.280.40 苏氨酸Thr0.790.790.790.55
1)过瘤胃赖氨酸产品由北京亚禾营养高新技术有限责任公司提供,Lys含量为36%,过瘤胃率为80%;2)过瘤胃蛋氨酸产品由安迪苏生命科学制品有限公司提供,Met含量为44%,过瘤胃率为50%;3)过瘤胃苏氨酸产品由希杰饲料有限公司提供,Thr含量为40%,过瘤胃率为90% 1) Ruminal bypass Lys purchased by Yahe Nutrition Co., (36% content and 80% bypass rate); 2) Ruminal bypass Met purchased by Adisseo Co., (44.4% content, 50% bypass rate); 3) Ruminal bypass Thr purchased by King Technology Co., (40% content, 90% bypass rate) 1.5 样品采集与测定指标1.5.1 饲料样品采集与测定 试验过程中收集具有代表性的饲粮,按照AOAC(2000)[11]的方法测定营养成分,其中:总能(GE)以PARR-6400全自动氧弹量热仪测定,粗蛋白(CP)含量使用KDY-全自动凯氏定氮仪测定,粗脂肪(EE)含量采用ANKOM-XT15i全自动脂肪分析仪测定,粗灰分(Ash)含量使用马弗炉进行测定并计算有机物(OM)含量,中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量使用ANKOM-200 Fiber Analyzer进行测定,钙(Ca)含量使用TAS-986S型原子吸收光谱仪测定,磷(P)含量使用MAPADA UV-6100PC紫外可见分光度计进行测定,Lys、Met和Thr等AA含量按照GB/T 18246-2000的方法,采用日立L -8900氨基酸自动分析仪测定。 微视频中画面与画面之间的过渡称为转场,是一种重要的剪辑手法。它是叙事内容发展的需要,也是创造层次和结构的需要,会影响视频的节奏和叙述的流畅性。对于观众来说,转场就是要达到视觉上的连续性和心理上的隔断性效果。视觉的连续性,是在剪辑过程中利用转场技巧,使观众在视觉上看到的场面或段落之间的转换过渡流畅自然;心理的隔断性,是使观众心里清楚上一个段落结束,下一个段落开始,保证叙事的逻辑性和层次的明晰性[2]。 1.5.2 生长性能 详细记录每天每头犊牛的剩料量并计算干物质采食量(DMI),在正试期第1、30、60、90天晨饲前测定每头犊牛的体重、体尺指标(体高、体斜长、十字部高、胸围、腹围、腰角宽)和乳头长度,计算ADG和饲料转化效率。每天8:00—19:00不间断观察犊牛粪便情况并评分:1分为正常,条形或粒状;2分为正常,粪便可以成型,相对软;3分为不正常,不成形,较稀;4分为不正常,粪水分离,颜色正常;5分为不正常,粪水分离,颜色有异常。粪便评分≥3记为腹泻,计算腹泻率公式为:腹泻率=粪便异常天数/试验总天数。 1.5.3 消化代谢试验 采用全收粪尿法,在犊牛132—138和173—179日龄每组选择6头接近平均体重的健康犊牛进行2期消化代谢试验,每期7 d,预饲期3 d,正试期4 d,记录每头犊牛正试期每日排粪量和排尿量,每天收集粪便总量的10%作为混合样品,每100 g新鲜粪便加入10%的稀硫酸10 mL固氮,每天收集尿总量的1%作为混合样品,用10%稀硫酸调试尿样使pH≤3,收集的粪、尿样放-20℃保存,粪中DM、GE、CP和OM以及尿能和尿氮的测定同上述方法和仪器。氮代谢及营养物质消化率计算公式参见文献[12],具体公式如下: 吸收N=食入N-粪N 沉积N=食入N-(粪N+尿N) “一带一路”为我国企业走出去带来了前所未有的新契机,正是因为前所未有,所以企业经验不足,缺乏相关的人才。现有的知晓国际税收的人才多数集中在大企业,中下层较少。同时,由于“一带一路”提出之前企业中懂得小语种的人才较少,或者是懂得的小语种种类较少,这也是走出去倡议中的绊脚石之一。面临这些挑战,国家与企业应该大力培养更多的人才,加强对相关领域人才的培训,引进更多新的人才。尽快培育出一批适应“一带一路”倡议需求的国际税收人才。 N消化率=吸收N/食入N 会整理的人,他就知道“今天跟客户进行这个阶段的商谈”“客户需要的是这个”等。因为很清楚,所以根本不会把有用的没用的全装进包里。头脑清楚,做工作当然有节奏有秩序,工作也能够顺利开展。 N利用率=沉积N/食入N N的生物学利用率(BV)=沉积N/消化N 1.6 统计分析BW、ADG、DMI、饲料转化效率和粪便评分采用SAS 8.1统计软件中关于重复测量数据的MIXED模型进行分析,体尺指标、腹泻率以及消化代谢数据使用ANOVA进行单因素方差分析,差异显著时采用Duncan法进行多重比较,P<0.05表示差异显著,0.05≤P<0.1表示具有提高和降低的趋势。 2 结果2.1 赖氨酸、蛋氨酸苏氨酸缺乏对犊牛生长性能的影响2.1.1 生长性能 扣除Lys、Met、Thr对犊牛生长性能的影响见表3,从表3可知,PC组与其余3组相比各个阶段ADG均差异不显著(P>0.05),PC-Met组90—180日龄的ADG显著高于PC-Lys组(P<0.05)。PC组120—150日龄阶段的DMI显著低于其他3组(P<0.05),但仅降低2.8%,各组间90—180日龄试验全期的DMI差异不显著(P>0.05)。与PC组相比,PC-Lys组90—120日龄、150—180日龄和90—180日龄阶段的饲料转化效率显著降低(P<0.05),PC-Met组和PC-Thr组与PC组相比,各阶段饲料转化效率均差异不显著(P>0.05)。 滑坡在航空正射影像的解译特征:一般成舌形、簸箕形、半圆形及不规则形,其中以半圆形状居多。滑坡坡体的色调与周围地物有明显的差别:刚发生不久的滑坡,在影像上呈现明显的浅色调;处于变形阶段的滑坡,滑体周缘常具有相比滑坡平面形态色调较浅的色环,见图5(b)。 表3 赖氨酸、蛋氨酸和苏氨酸缺乏对犊牛生长性能的影响 Table 3 Effects of Lys, Met and Thr deficiency on growth performance of calves 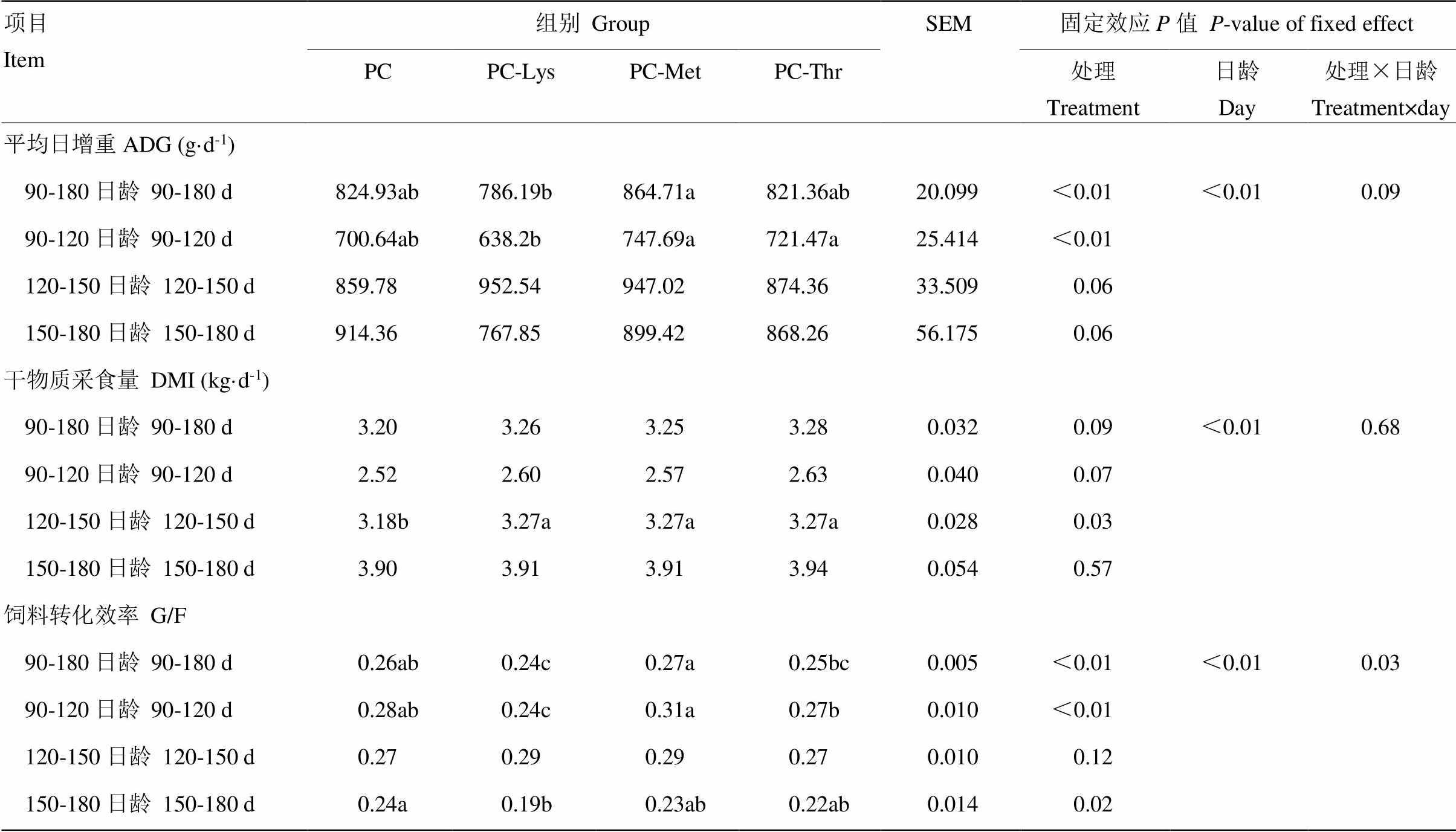 项目Item组别GroupSEM固定效应P值P-value of fixed effect PCPC-LysPC-MetPC-Thr处理Treatment日龄Day处理×日龄Treatment×day 平均日增重ADG (g·d-1) 90-180日龄90-180 d824.93ab786.19b864.71a821.36ab20.099<0.01<0.010.09 90-120日龄90-120 d700.64ab638.2b747.69a721.47a25.414<0.01 120-150日龄120-150 d859.78952.54947.02874.3633.5090.06 150-180日龄150-180 d914.36767.85899.42868.2656.1750.06 干物质采食量DMI (kg·d-1) 90-180日龄90-180 d3.203.263.253.280.0320.09<0.010.68 90-120日龄90-120 d2.522.602.572.630.0400.07 120-150日龄120-150 d3.18b3.27a3.27a3.27a0.0280.03 150-180日龄150-180 d3.903.913.913.940.0540.57 饲料转化效率G/F 90-180日龄90-180 d0.26ab0.24c0.27a0.25bc0.005<0.01<0.010.03 90-120日龄90-120 d0.28ab0.24c0.31a0.27b0.010<0.01 120-150日龄120-150 d0.270.290.290.270.0100.12 150-180日龄150-180 d0.24a0.19b0.23ab0.22ab0.0140.02
同行数据具有不同小写字母表示差异显著(P<0.05)。下同 In the same row, values with different small letter mean significant difference (P<0.05). The same as below 2.1.2 体尺指标 由表4可知,各组间体高、体斜长、十字部高、胸围、腹围和腰角宽的初始值差异均不显著(P>0.05),与此同时,各组间体尺指标的增长率也差异不显著(P>0.05),从数值上看,PC-Thr组试验全期体斜长、腹围和腰角宽的增长率为各组最高值。 表4 赖氨酸、蛋氨酸、苏氨酸缺乏对犊牛体尺的影响 Table 4 Effects of Lys, Met and Thr deficiency on body measurements of calves 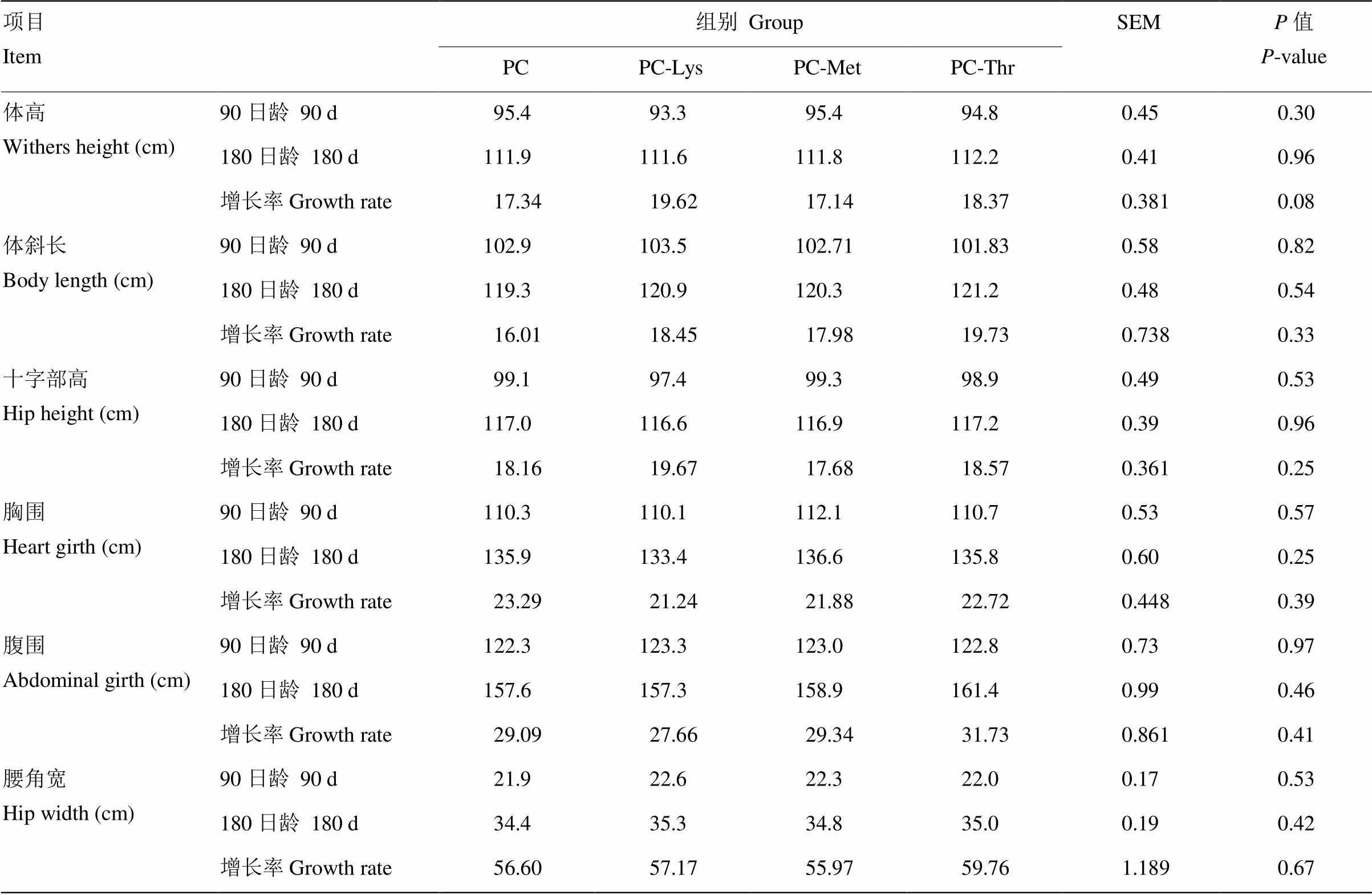 项目Item组别GroupSEMP值P-value PCPC-LysPC-MetPC-Thr 体高Withers height (cm)90日龄90 d95.493.395.494.80.450.30 180日龄180 d111.9111.6111.8112.20.410.96 增长率Growth rate17.3419.6217.1418.370.3810.08 体斜长Body length (cm)90日龄90 d102.9103.5102.71101.830.580.82 180日龄180 d119.3120.9120.3121.20.480.54 增长率Growth rate16.0118.4517.9819.730.7380.33 十字部高Hip height (cm)90日龄90 d99.197.499.398.90.490.53 180日龄180 d117.0116.6116.9117.20.390.96 增长率Growth rate18.1619.6717.6818.570.3610.25 胸围Heart girth (cm)90日龄90 d110.3110.1112.1110.70.530.57 180日龄180 d135.9133.4136.6135.80.600.25 增长率Growth rate23.2921.2421.8822.720.4480.39 腹围Abdominal girth (cm)90日龄90 d122.3123.3123.0122.80.730.97 180日龄180 d157.6157.3158.9161.40.990.46 增长率Growth rate29.0927.6629.3431.730.8610.41 腰角宽Hip width (cm)90日龄90 d21.922.622.322.00.170.53 180日龄180 d34.435.334.835.00.190.42 增长率Growth rate56.6057.1755.9759.761.1890.67
2.1.3 乳头长度 由表5可知,PC-Lys组90日龄时左后、右后和右前的乳头长度均显著大于PC组和PC-Met组(P<0.05),经过90 d生长后,180日龄时各组间乳头长度差异不显著(P>0.05)。与PC组相比,PC-Lys组的各个乳头长度的增长率虽差异不显著但均小于PC组(P>0.05)。PC-Met组和PC-Thr组与PC组相比各乳头长度的增长率均差异不显著(P>0.05)。 2.1.4 粪便评分和腹泻率 由表6可知,Lys、Met和Thr对犊牛的腹泻率没有显著影响(P>0.05),但PC-Lys组腹泻率最高,与PC组腹泻率相比增加了3.4%。与PC组相比,PC-Lys组和PC-Thr组的粪便评分显著升高(P<0.05)。由图1可知,PC-Lys组和PC-Thr组的粪便评分从正试期第5周开始始终高于PC组。 2.2 赖氨酸、蛋氨酸、苏氨酸缺乏对犊牛营养物质消化率和氮代谢的影响2.2.1 营养物质表观消化率 由表7可知,Lys、Met和Thr对犊牛135—138日龄和176—179日龄的DM、OM和GE表观消化率没有显著影响(P>0.05),176—179日龄犊牛的营养物质表观消化率均高于135—138日龄时期。 2.2.2 氮代谢 由表8可以看出Lys、Met和Thr缺乏对犊牛135—138日龄的氮代谢指标没有显著影响(P>0.05)。在176—179日龄阶段,与PC组相比,PC-Lys组的尿氮排出量显著升高,氮利用率和氮的生物学价值显著降低(P<0.05),沉积氮和总排出氮无显著影响但具有差异显著的趋势(P>0.05)。PC-Met和PC-Thr组尿氮、氮利用率和氮表观生物学价值与PC组相比则没有显著差异(P>0.05)。 表5 赖氨酸、蛋氨酸和苏氨酸缺乏对犊牛乳头发育的影响 Table 5 Effects of Lys, Met and Thr deficiency on nipple development of calves  项目Item日龄Days of age组别GroupSEMP值P-value PCPC-LysPC-MetPC-Thr 左后Left rear (mm)90日龄90 d14.9b17.6a13.9b16.2ab0.450.01 180日龄180 d23.525.123.426.40.530.17 增长率Growth rate61.8ab47.2b74.1a63.7ab3.290.03 左前Left front (mm)90日龄90 d14.917.314.815.90.410.10 180日龄180 d27.428.826.226.90.560.40 增长率Growth rate81.970.382.569.34.190.55 右后Right rear (mm)90日龄90 d14.0b16.4a13.8b15.7ab0.390.03 180日龄180 d20.923.322.824.10.530.19 增长率Growth rate61.357.971.473.03.780.41 右前Right front (mm)90日龄90 d15.9b18.1a14.7b15.8b0.420.02 180日龄180 d25.528.326.227.90.500.14 增长率Growth rate53.4ab45.8b69.5a53.6ab3.050.03
表6 赖氨酸、蛋氨酸、苏氨酸缺乏对犊牛腹泻率及粪便评分的影响 Table 6 Effects of Lys, Met and Thr deficiency on the diarrhea rate and fecal score of calves 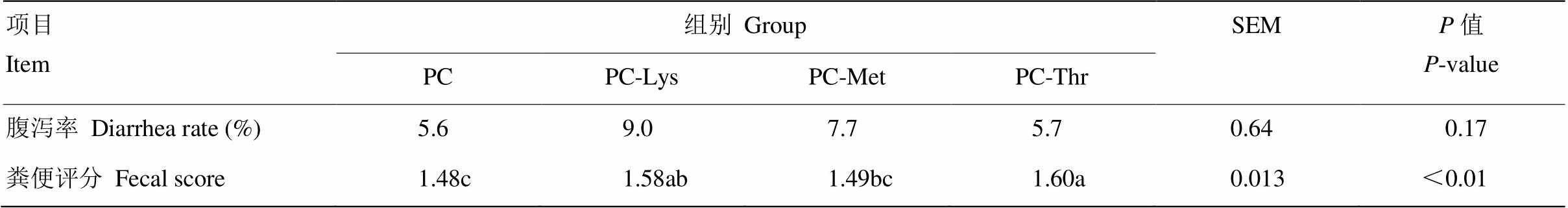 项目Item组别GroupSEMP值P-value PCPC-LysPC-MetPC-Thr 腹泻率Diarrhea rate (%)5.69.07.75.70.640.17 粪便评分Fecal score1.48c1.58ab1.49bc1.60a0.013<0.01
图1 赖氨酸、蛋氨酸和苏氨酸缺乏对犊牛粪便评分的影响 Fig. 1 Effects of Lys, Met and Thr deficiency on the fecal score of calves 表7 赖氨酸、蛋氨酸、苏氨酸缺乏对犊牛营养物质表观消化率的影响 Table 7 Effects of Lys, Met and Thr deficiency on the nutrient metabolism calves 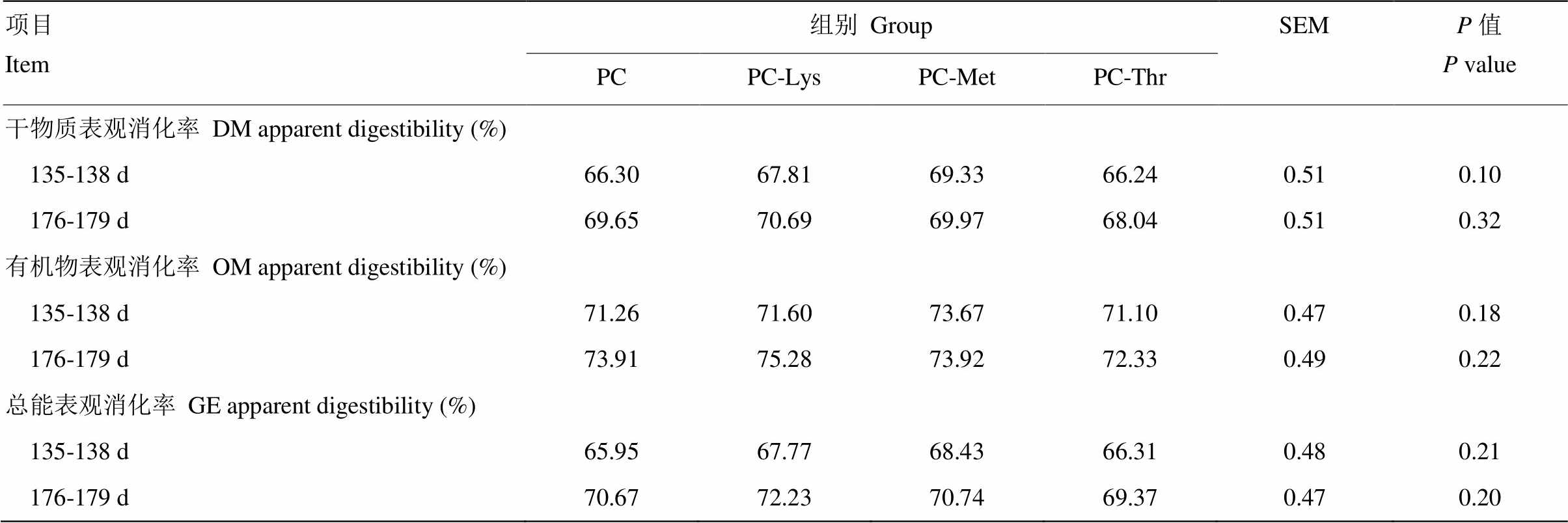 项目Item组别GroupSEMP值P value PCPC-LysPC-MetPC-Thr 干物质表观消化率DM apparent digestibility (%) 135-138 d66.3067.8169.3366.240.510.10 176-179 d69.6570.6969.9768.040.510.32 有机物表观消化率OM apparent digestibility (%) 135-138 d71.2671.6073.6771.100.470.18 176-179 d73.9175.2873.9272.330.490.22 总能表观消化率GE apparent digestibility (%) 135-138 d65.9567.7768.4366.310.480.21 176-179 d70.6772.2370.7469.370.470.20
表8 赖氨酸、蛋氨酸、苏氨酸缺乏对犊牛的氮代谢的影响 Table 8 Effects of Lys, Met and Thr deficiency on the nitrogen metabolism of calves 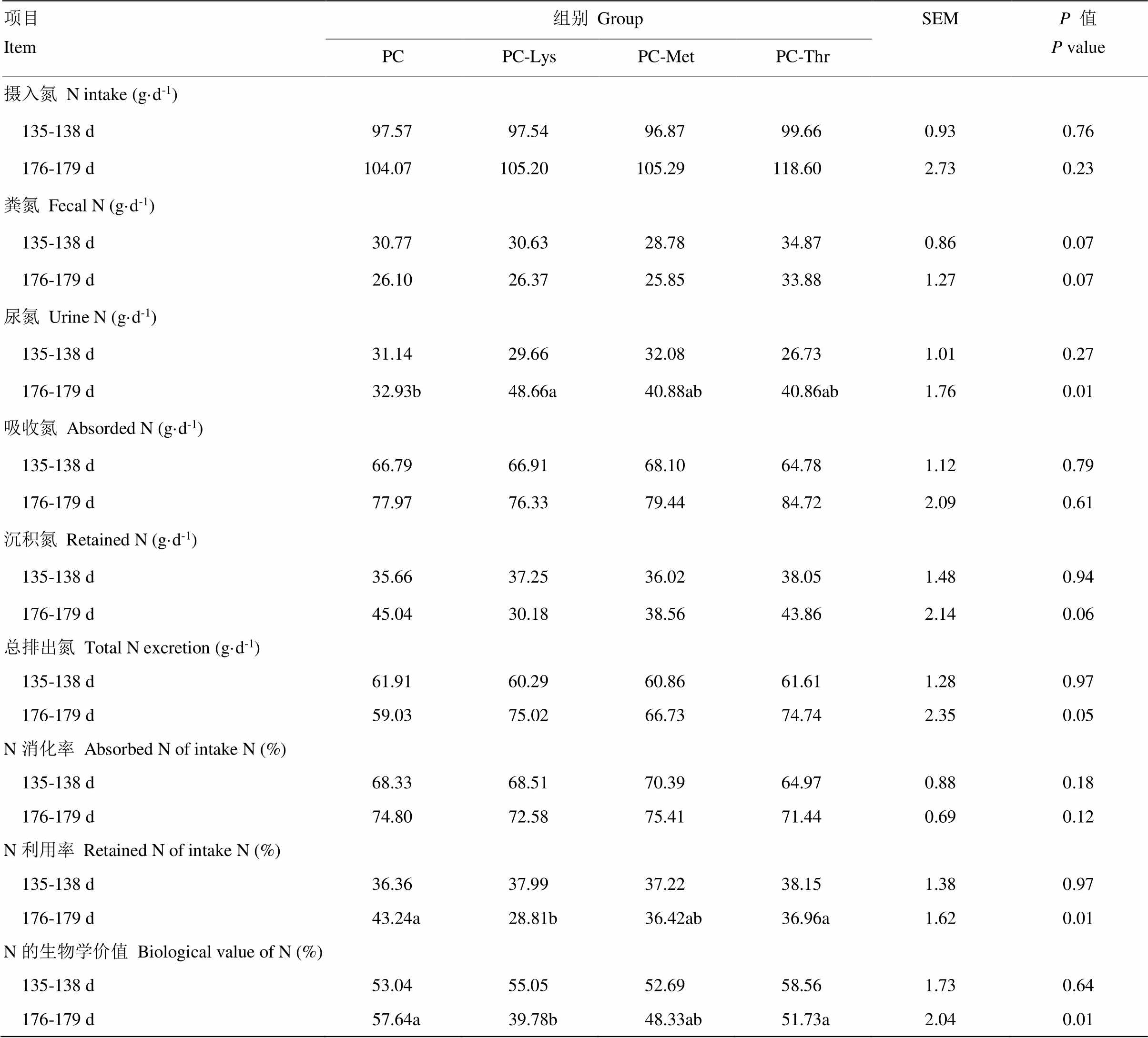 项目Item组别GroupSEMP值P value PCPC-LysPC-MetPC-Thr 摄入氮N intake (g·d-1) 135-138 d97.5797.5496.8799.660.930.76 176-179 d 104.07 105.20 105.29 118.60 2.730.23 粪氮Fecal N (g·d-1) 135-138 d30.7730.6328.7834.870.860.07 176-179 d 26.10 26.37 25.85 33.88 1.270.07 尿氮Urine N (g·d-1) 135-138 d31.1429.6632.0826.731.010.27 176-179 d 32.93b 48.66a 40.88ab 40.86ab 1.760.01 吸收氮Absorded N (g·d-1) 135-138 d66.7966.9168.1064.781.120.79 176-179 d 77.97 76.33 79.44 84.72 2.090.61 沉积氮Retained N (g·d-1) 135-138 d35.6637.2536.0238.051.480.94 176-179 d 45.04 30.18 38.56 43.86 2.140.06 总排出氮Total N excretion (g·d-1) 135-138 d61.9160.2960.8661.611.280.97 176-179 d 59.03 75.02 66.73 74.74 2.350.05 N消化率Absorbed N of intake N (%) 135-138 d68.3368.5170.3964.970.880.18 176-179 d 74.80 72.58 75.41 71.44 0.690.12 N利用率Retained N of intake N (%) 135-138 d36.3637.9937.2238.151.380.97 176-179 d 43.24a 28.81b 36.42ab 36.96a 1.620.01 N的生物学价值Biological value of N (%) 135-138 d53.0455.0552.6958.561.730.64 176-179 d 57.64a 39.78b 48.33ab 51.73a 2.040.01
3 讨论3.1 赖氨酸、蛋氨酸和苏氨酸缺乏对犊牛生长性能的影响Lys、Met和Thr经研究后被证实是多种动物、处于多个生长阶段的前三位重要限制性氨基酸(LAA)[13-15],但是NRC奶牛营养需要量(2001)并未明确给出各AA的需要量[4],而NRC肉牛营养需要量(2016)也仅按照生长、泌乳和妊娠时所需的净蛋白量计算AA需要量,其中生长阶段肉牛的AA需要量则是通过组织蛋白中AA的组成计算,但数据单一,并未根据生理阶段和消化方式的不同进行详细划分[5],所以后备荷斯坦奶牛AA的需要量仍需详尽研究。本试验为探究Lys、Met和Thr缺乏对3—6月龄母犊牛生长发育和营养物质消化代谢的影响,根据ZINN等研究得到的荷斯坦后备牛Met需要量预测模型,代入本试验荷斯坦母牛的BW和ADG得到较为准确的Met需要量[7],Lys和Thr添加量由于缺乏相关研究结果,所以按照同为生长阶段的猪适宜氨基酸比例(100﹕33﹕65)计算得出[8],其中Lys﹕Met= 3﹕1与本团队在断奶后公犊牛上的研究结果相近[16]。在缺乏3—6月龄中国荷斯坦后备牛饲粮AA需要量的情况下,采用上述方法确定PC组的AA水平是无奈之举也是探索性的尝试,本试验结果也显示了PC组的综合生长性能较好,从侧面证实了本研究计算得出的PC组AA水平和比例可以满足3—6月龄中国荷斯坦母犊牛的需要。 本试验每天饲粮干物质投喂量按照犊牛BW的3%计算,各组犊牛90—180日龄的平均DMI差异不显著,这也保证了犊牛除AA摄入量不同以外其余营养素摄入量保持一致。结果显示扣除饲粮中30%的Lys使犊牛的饲料转化效率降低,ADG降低了16.02%,而扣除30%Met和Thr对犊牛ADG和饲料转化效率没有影响。MONTAÑO等[16]研究认为后备牛BW和ADG随Lys供应量的减少而线性降低,云强等[17]将断奶后公犊牛Lys水平由0.96%降低到0.8%,Lys降低16.67%使ADG降低了10.55%,与本试验的结果类似,Lys作为LAA在体内无法合成并且参与体内多种营养物质的合成过程,包括胶原蛋白[18]和肉毒碱前体物质[19]的合成,扣除30%的Lys可能会对这些体内的合成代谢有影响,从而降低了饲料转化效率。TORRENTERA等[20]使用平均体重为157 kg的荷斯坦公犊牛探究不同Met添加量对生长性能的影响,结果显示在确保Lys供应充足的情况下额外提供0.128%的Met对生长性能没有影响,HERSOM等[21]在10月龄后备牛的饲粮中分别添加2、4、6、8 g·d-1的蛋氨酸羟基类似物也同样对生长性能无影响,本试验Met含量由0.33%降低到0.22%、每天Met供应量由12 g减少到8 g同样对生长性能没有影响。而在断奶前犊牛有关Met的研究中发现,Met的添加或扣除均会对生长性能产生显著影响[22-23],这说明随着犊牛的生长,牛只对Met的敏感性在逐渐降低,归结其原因可能在于Met结构的特殊性,Met作为含硫氨基酸向机体提供一碳单位以合成嘌呤和嘧啶,同样具有该功能的还有胆碱和半胱氨酸,随着犊牛断奶后采食饲粮原料的丰富,可能Met的功能被部分替代[24]。关于Thr在犊牛上的研究较少,Hill等[25]将新生犊牛饲粮中Thr含量由1.06%提升到1.43%对ADG和DMI没有显著影响,还有研究扣除犊牛代乳品中30%的Thr同样对犊牛ADG和饲料转化效率没有显著影响[7],Thr最直接的功能是参与合成维持肠道完整性的黏蛋白和维持免疫功能[26],所以本试验的结果可能与Thr的主要营养作用在于完善免疫功能而非促生长作用有关。 体尺反映了牛体格的大小,也体现了牛生长发育阶段饲养管理水平的高低和遗传潜力的大小,后备牛阶段是奶牛体格的定型时期,其中又以0—6月龄犊牛的生长强度最大[27],此时乳房的发育处于异速生长阶段,期间乳腺软组织细胞的发育速度是3月龄前的3—4倍。黄文明[28]对中国8个大型牧场的荷斯坦后备奶牛体尺进行了统计,得到了中国荷斯坦后备奶牛各项体尺指标的平均值,本试验结束时犊牛各项体尺指标均大于其统计的体尺平均值,这说明3—6月龄时扣除犊牛30%的Lys、Met和Thr对体格发育没有影响。该结果与前人在犊牛和生长水牛上研究的结果相一致[7,29],黄文明研究的结果显示尽管位于中国不同地点的8个牧场使用不同的管理模式和饲粮组成,但15月龄之前的后备牛体尺指标不存在显著性差异,也揭示出后备牛体格生长不易受到影响。 由本试验结果可知,扣除30%的Lys对乳房发育有一定的抑制作用,乳头增长率在数值上均小于饲喂氨基酸平衡日粮的犊牛,而扣除30%的Met和Thr则无此效果。有研究报道处于青春期的雌性哺乳动物乳房由生长激素(GH)、胰岛素样生长因子(IGF-Ⅰ)、雌激素和孕酮调控发育[30],其中又以IGF-Ⅰ作用最为强烈[31],唐波[32]在犊牛饲粮中每天添加4 g蛋氨酸羟基类似物对血清中GH和IGF-Ⅰ含量没有影响,说明乳房发育对Met供给的增加或减少并不敏感,这与本试验的结果相同,郭朝龙[33]对泌乳山羊进行静脉Lys灌注以导致Lys梯度缺失,结果显示当灌注液中Lys 浓度为0时,IGF-Ⅰ浓度降低12.33%,这说明Lys对IGF-Ⅰ有一定影响,这可能会影响乳房的发育。 腹泻是犊牛时期的重要致病原因之一。在本试验中,PC组犊牛的腹泻情况较多,这与张乃锋[23]的研究结果一致。此外,结果显示扣除Lys和Thr显著降低了粪便评分,其中PC-Thr组的腹泻率较低,粪便评分较高,说明该组腹泻犊牛数量较少,但多为相对严重腹泻,而PC-Lys组则是腹泻率高,但粪便评分较低,说明该组腹泻犊牛数量较多,多为轻度腹泻。对于新生犊牛来说,腹泻的诱因十分复杂,如初乳质量、初乳饲喂时间和饲养环境等。但对于3—6月龄断奶后犊牛来说,由于与新生犊牛相比免疫系统相对发育健全和稳定,所以该阶段犊牛腹泻的原因多归因于胃肠道微生物感染,Thr的功能在于合成肠黏液层的黏蛋白和体内的免疫球蛋白G[26],一旦犊牛感染腹泻,由于犊牛相对缺乏Thr,肠道屏障的不完整性和自身免疫球蛋白G数量的降低会导致腹泻情况加重,不易康复,而PC-Lys组则因为体质偏弱,多为轻度腹泻,虽发病率较高却容易康复。此外,二者对粪便评分的影响均在试验开始5周后显现,说明二者对犊牛腹泻的影响需要长期的累加。 3.2 赖氨酸、蛋氨酸和苏氨酸缺乏对犊牛营养物质表观消化率和氮代谢的影响由两期营养物质表观消化率的结果可以看出3—6月龄阶段犊牛的消化系统已经发育完全,虽营养物质表观消化率在随日龄增长,但变化较小,可能微生物发酵功能也已经趋于稳定[34]。反刍动物相较于单胃动物在AA代谢上的最大不同之处在于存在瘤胃微生物对AA的发酵作用,AA在瘤胃内被微生物脱羧和脱氨产生氨、挥发性脂肪酸和二氧化碳,这些分解代谢产生的代谢物会进一步被微生物利用生成微生物蛋白,这一过程使非必需氨基酸转变为必需氨基酸,但对饲料中LAA存在破坏作用,所以对LAA进行物理或化学包被可优化小肠AA的模式,在饲粮中添加过瘤胃氨基酸已经在奶牛产奶量[35]、繁殖性能[36]、发病率[37]和肉品质[38]等性状上取得了优化效果。本试验在3—6月龄犊牛饲粮中添加三种过瘤胃氨基酸,结果显示AA的部分扣除对营养物质表观消化率没有影响,HUSSEIN等[39]每天通过皱胃瘘管向荷斯坦生长公牛提供6 g的Lys同样对DM表观消化率和OM表观消化率没有影响,HILL等[40]以两种不同AA来源的饲粮为基础饲粮并额外添加0.1%的液体Met,发现Met对营养物质表观消化率没有影响,SAI[41]报道称6月龄犊牛额外添加2 g的RPMet和17 g的RPLys同样对DM表观消化率和OM表观消化率没有影响,这可能与过瘤胃氨基酸的产品特性有关,过瘤胃氨基酸未在瘤胃中被微生物发酵生成挥发酸或合成微生物蛋白,所以,在基础饲粮完全相同的情况下,各营养物质在胃肠中的消化情况应相近。但也有研究报道高浓度的代谢葡萄糖使非必须氨基酸和Lys的表观消化率显著降低[42],原因可能是十二指肠中葡萄糖和AA对转运载体存在竞争,二者在小肠上皮的吸收均依赖钠泵活动形成的主动转运过程和载体介导的易化扩散[43],所以AA供给的增多同样会影响有机物的消化率,本试验并未过量添加AA,所以对有机物在肠道的吸收不存在竞争载体现象。 之所以动物机体对不同AA的需要量不同,原因在于各AA的结构不同,进而导致AA在动物体内参与的代谢途径不同,各代谢途径之间存在着相互的交叉,或抑制或促进。关于AA在动物体内的代谢途径,在单胃动物上有较为详细的研究,反刍动物则鲜有报道。几年来在单胃动物上发现了肠道在吸收AA过程中的AA代谢过程,包括为小肠黏膜细胞提供能量,为小肠粘膜细胞和肠腔微生物合成蛋白质、AA、谷胱甘肽、嘌呤和嘧啶等[44-45],AA被小肠吸收后经门静脉进入肝脏,其中,Lys最主要的分解代谢途径是在一系列代谢酶的作用下生成乙酰辅酶A,从而转化为脂肪和酮体,Lys通过合成途径形成的蛋白质在近年来被揭示存在多种Lys酰化途径,KIM等[46]在环腺苷酸应答元件结合蛋白3的bZIP区域发现了Lys去乙酰化位点,可经过乙酰化后促进脂质代谢平衡。沈佳佳等[47]详细介绍了蛋白质中Lys琥珀酰化与炎症反应、缺血再灌注损伤和过敏性皮炎的联系,揭示了含有Lys的蛋白通过翻译后酰化调控广泛的生命活动;Met到达肝脏后存在经典的转甲基途径,该途径中脱去的一碳甲基、牛磺酸、丙酮酸和谷胱甘肽均在动物机体中有重要作用;Thr区别于Lys和Met,是体内唯一无脱氨和转氨反应的AA,在体内存在的分解代谢途径有3条:(1)通过苏氨酸脱氢酶代谢为氨基丙酮、甘氨酸和乙酰辅酶A;)2)通过苏氨酸脱水酶代谢为丙酸和α-氨基丁酸;(3)通过苏氨酸醛缩酶代谢为甘氨酸和乙酰辅酶A,Thr的合成途径则主要参与免疫物质的组成[48]。以上代谢途径说明不同AA之间有交叉的代谢部分也有特有的代谢途径,这就导致某一AA的缺失会不同程度上导致代谢的停止和影响营养物质的沉积。云强等[16]将断奶后犊牛饲粮中Lys水平由0.96%降低到0.8%,使N利用率由46.43%降低到41.56%;栾玉静等[49]在装有瘤胃瘘管的10月龄杂交肉牛瘤胃中每天投入15 gRPLys,结果显示N利用率由59.31%提升到64.84%;ALFERINK等[50]通过颈静脉注射给平均体重为157 kg的荷斯坦公牛每天9.3 g赖氨酸盐和6 g苏氨酸盐,研究发现AA静脉注射使N的生物学价值由32.5%提升到46.8%。虽然AA供给方式不同,本试验通过分别扣除饲粮中30%的Lys、Met和Thr均对N沉积有不同程度的影响,其中Lys对N利用率影响程度最大,Met和Thr次之,由此可见,影响N利用率或N沉积的根本原因在于AA扣除增加了尿氮的排出量,说明扣除LAA对营养物质吸收后的代谢过程存在影响,具体的影响机制还需对AA在体内的代谢过程进行跟踪。此外,136—138日龄时的氮代谢情况并没有受到AA扣除的影响,直到176—179日龄时才显示出氮代谢的异常效果,出现该现象的原因在于机体的适应性,有研究发现动物在AA缺乏的状态下有一系列的自适应调节,包括一般性调控阻遏蛋白激酶(general control non-repressed 2,GCN2)磷酸化翻译起始因子2以降低全局翻译的速率,从而减少胞内AA的内耗[51-52];GCN2、雷帕霉素靶蛋白1启动自噬基因转录,对细胞组分糖原、脂质和细胞器进行酶解从而生成基础营养素等。但机体的适应能力有限,无法长期维持体内代谢,原本GCN2路径激活的转录因子4会与γ-氨基丁酸受体1亚基作用,下调脑中前梨状皮层的多巴胺神经元的γ-氨基丁酸信号通路,以降低多巴胺的分泌,进而抑制采食,这有助于停止采食AA不平衡的饲粮,直到采食AA平衡饲粮并恢复多巴胺分泌[53],但本试验始终提供AA相对不平衡饲粮并采取了限饲措施,所以长期以往还是会引起AA的缺乏,短期则存在补救效应。 4 结论①3—6月龄犊牛饲喂缺乏30%赖氨酸的饲粮显著降低了饲料转化效率,提高了粪便评分,而扣除饲粮中30%的蛋氨酸和苏氨酸对犊牛生长性能没有影响。 4.3.3 颗粒物浓度监测季节变化。从图13~图18可以看出,颗粒物浓度主要是在冬季和秋季较高,夏季颗粒物浓度最低的峰谷峰的变化形式,其中PM10会出现春季峰值的情况。 ②3—6月龄犊牛饲喂缺乏30%赖氨酸、蛋氨酸和苏氨酸的饲粮对体格发育和营养物质表观消化率没有影响,但缺乏30%赖氨酸抑制了乳头的发育。 ③3—6月龄犊牛饲喂缺乏30%赖氨酸的饲粮增加了176—179日龄时的尿氮排放量,对氮代谢有负面影响。 MIGA公约第11条明确规定了MIGA承保的非商业风险范围有货币汇兑险、征收和类似措施险、违约险、战争和内乱险、应投资者和东道国联合申请经董事会特别多数通过的其他非商业风险,但任何情况下不包括货币的贬值或降值。与中国海外投资安全风险直接相关的险种主要是战争和内乱险。 综合以上结论,在本试验条件下,3—6月龄中国荷斯坦母犊牛对饲粮中赖氨酸浓度较为敏感,赖氨酸供给的不足将通过降低生长性能、氮沉积、抑制乳头发育和加重腹泻情况对犊牛生长发育产生影响,扣除苏氨酸仅体现在影响犊牛腹泻上,而蛋氨酸对犊牛则没有任何影响,所以在配置该阶段犊牛饲粮时应重点关注苏氨酸的供给量是否充足。 烘干衣物的生活方式源自西方发达国家,由于健康、便捷、省时,近几年逐渐被我国消费者所接受,但目前主要聚集在高端市场。作为导入期的品类,线下在产品体验等方面具有天然优势,销量上更胜一筹。随着消费者对干衣机、洗烘一体机的了解、接受度提高,干衣市场可望迎来快速成长。 References [1] SOBERON F, RAFFRENATO E, EVERETT R W, VAN A M E. Preweaning milk replacer intake and effects on long-term productivity of dairy calves. Journal of Dairy Science, 2012, 95(2): 783-793. [2] QIN T, WANG H, BU D, HAO H, WANG D, ZHU H. Effects of two different forage sources on mammary gland growth, mammary cell turnover and activity in early lactation dairy cows. Animal Production Science, 2015, 55(5): 630-633. [3] 么学博, 杨红建, 谢春元, 岳群,王加启. 反刍家畜常用饲料蛋白质和氨基酸瘤胃降解特性和小肠消化率评定研究. 动物营养学报, 2007, 19(3): 225-231. ME X B, YANG H J, XIE C Y, YUE Q, WANG J Q. In situ degradability characteristics of crude protein and amino acids in the rumen and small intestinal digestibility using the mobile nylon bag with ruminant feedstuffs. Chinese Journal of Animal Nutrition, 2007, 19(3): 225-231. (in Chinese) [4] NATION RESEARCH COUNCIL. Nutrient Requirements of Dairy Cattle. 7th revised. Washington, D. C: National Academies Press, 2001. [5] NATION RESEARCH COUNCIL. Nutrient Requirements of Beef Cattle. 8th revised. Washington, D. C: National Academies Press, 2016. [6] WANG T C, FULLER M F. The optimum dietary amino acid pattern for growing pigs. British Journal of Nutrition, 1989, 62(1): 77-89. [7] 王建红. 0~2月龄犊牛代乳品中赖氨酸、蛋氨酸和苏氨酸适宜模式的研究[D]. 北京: 中国农业科学院, 2010. WANG J H. Study on the optimum amino acid pattern in milk replacers for calves aged 0 to 2 months[D]. Beijing: Chinese Academy of Agricultural Sciences, 2010. (in Chinese) [8] ZINN R A, SHEN Y. An evaluation of ruminally degradable intake protein and metabolizable amino acid requirements of feedlot calves. Journal of Animal Science, 1998, 76(5): 1280-1289. [9] CHUNG T K, BAKER D H. Ideal amino acid pattern for 10-kilogram pigs. Journal of Animal Science, 1992, 70(10): 3102-3111. [10] EGGLESTON S, BUENDIA L, MIWA K, Ngara T, Tanabe K. 2006 IPCC Guidelines for national greenhouse gas inventories, intergovernmental panel on climate change (IPCC),2006. [11] AOAC. Official methods of analysis of the association of official analytical chemists[S]. 17th ed. Arlington: AOAC, 2000. [12] 计成. 动物营养学. 北京:高等教育出版社, 2008. JI C. Animal Nutrition. Beijing: Higher Education Press, 2008. (in Chinese) [13] 李雪玲, 柴建民, 张乃锋, 张蓉, 王杰, 王世琴, 陶大勇, 刁其玉. 断奶羔羊4种必需氨基酸限制性顺序和需要量模型探索. 动物营养学报, 2017, 29(1): 106-117. LI X L, CAI J M, ZHANG N F, ZHANG R, WANG J, WANG S Q, TAO D Y, DIAO Q Y. Exploration of requirement models and limiting sequence of four kinds of essential amino acids of weaned lambs. Chinese Journal of Animal Nutrition, 2017, 29(1): 106-117. (in Chinese) [14] 王建红, 刁其玉, 许先查, 屠焰, 张乃锋. 不同生理阶段犊牛赖、蛋、苏氨酸平衡模式研究. 饲料工业, 2010, 31(19): 39-42. WANG J H, DIAO Q Y, XU X C, TU Y, ZHANG N F. The proper ratio of lysine, methionine and threonine for calves from 0 to 2 months of age. Feed Industry, 2010, 31(19): 39-42. (in Chinese) [15] 万蒙. 食物组成及其氨基酸平衡对大熊猫血液生化指标的影响研究[D]. 硕士学位论文. 雅安: 四川农业大学, 2016. WAN M. Study on effects of food composition and amino acid balance on giant panda’s biochemical indicators[D]. Yaan: Sichuan Agricultural University. (in Chinese) [16] MONTAÑO M F, TEJADA W, SALINAS J, ZINN R A. Metabolizable amino acid requirements of feedlot calves. Open Journal of Animal Sciences, 2016, 6(2): 149-155. [17] 云强, 刁其玉, 屠焰, 张乃锋, 王建红, 周盟. 饲粮中赖氨酸和蛋氨酸比对断奶犊牛生长性能和消化代谢的影响. 中国农业科学, 2011, 44(1): 133-142. YUN Q, DIAO Q Y, TU Y, ZHANG N F, WANG J H, ZHOU M. Effects of dietary lysine to methionine ratio on growth performance, nutrient digestibility, and metabolism in weaned calves. Scientia Agricultura Sinica, 2011, 44(1): 133-142. (in Chinese) [18] LIU X, DAN N, DAN W. Insight into the collagen assembly in the presence of lysine and glutamic acid: an in vitro study. Materials Science & Engineering C, 2017, 70: 689-700. [19] SERVILLO L, GIOVANE A, CAUTELA D, CASTALDO D, BALESTRIERI M L. Where does N(ε)-trimethyllysine for the carnitine biosynthesis in mammals come from?. Plos One, 2014, 9(1): 1-7. [20] TORRENTERA N, CARRASCO R, SALINAS-CHAVIRA J, PLASCENCIS A, ZINN R A. Influence of methionine supplementation of growing diets enriched with lysine on feedlot performance and characteristics of digestion in Holstein steer calves. Asian-Australasian Journal of Animal Sciences, 2017, 30(1): 42-50. [21] HERSOM M J, M VÁZQUEZ-AÑÓN, LADYMAN K P, KERLEY M S, ARTHINGTON J D. Effect of methionine source and level on performance of growing beef calves consuming forage-based diets. The Professional Animal Scientist, 2009, 25(4): 465-474. [22] CHAGAS J C C,FERREIRA M A,FACIOLA A P, MACHADO F S, CAMPOS M M, ENTJES M R, DONZELE J L, MARCONDES M I. Effects of methionine plus cysteine inclusion on performance and body composition of liquid-fed crossbred calves fed a commercial milk replacer and no starter feed. Journal of Dairy Science, 2018, 101: 6055-6065. [23] 张乃锋. 蛋白质与氨基酸营养对早期断奶犊牛免疫相关指标的影响[D]. 北京: 中国农业科学院, 2008. ZHANG N F. Effects of protein and amino acid nutrition on indexes relaxed to immune response of early weaned dairy calve[D]. Beijing: Chinese Academy of Agricultural Sciences, 2008. (in Chinese) [24] 马晨, 陈玉. 过瘤胃蛋氨酸、甜菜碱和胆碱在奶牛生产中的应用. 新饲料, 2016(6): 37-39. MA C, CHEN Y. Application of rumen - passing methionine, betaine and choline in dairy cattle production. New Feed, 2016(6): 37-39.(in Chinese) [25] HILL T M, II H G B, ALDRICH J M, SCHLOTTERBECK R L, TANAN K G. Optimal concentrations of lysine, methionine and threonine in milk replacers for calves less than five weeks of age. Journal of Dairy Science, 2008, 91(6): 2433-2442. [26] WU G. Amino acids: metabolism, functions, and nutrition. Amino Acids, 2009, 37(1): 1-17. [27] 刁其玉, 屠焰, 周怿. 后备牛营养需要与培育的研究进展. 当代畜禽养殖业, 2011(11): 22-26. DIAO Q Y, TU Y, ZHOU Y. Advances in research on the nutritional needs and cultivation of reserve cattle. Modern Animal Husbandry, 2011(11): 22-26. (in Chinese) [28] 黄文明. 荷斯坦后备奶牛体尺和血液生化指标的测定与分析[D]. 杭州: 浙江大学, 2016. HUANG W M. The detection and analysis of body size parameters and blood biochemical indexes for holstein heifers[D]. Hangzhou: Zhejiang University, 2016. (in Chinese) [29] GAJERA A P,DUTTA K S,PARSANA D K, SAVSANI H H, ODEDRA M D, GAJBHIYE P U, MURTHY K S, CHAVDA J A. Effect of bypass lysine, methionine and fat on growth and nutritional efficiency in growing Jaffrabadi heifers. Veterinary World, 2013, 6(10): 766-769. [30] REZAEI R, WU Z, HOU Y, BAZER F W, WU G. Amino acids and mammary gland development: nutritional implications for milk production and neonatal growth. Journal of Animal Science & Biotechnology, 2016, 7(4): 437-458. [31] PLATHGABLER A, GABLER C, SINOWATZ F, BERISHA B, SCHAMS D. The expression of the IGF family and GH receptor in the bovine mammary gland. Journal of Endocrinology, 2001, 168(1): 39-48. [32] 唐波.蛋氨酸羟基类似物异丙酯(HMBi)对肉牛育肥性能和血液指标以及H-FABP基因mRNA表达水平的影响[D]. 南京: 南京农业大学, 2014. TANG B. Effects of supplementing 2-hydroxy-4-(methylthio) butanoic acid isopropyl ester on finishing performance, blood index levels and the h-fabp gene mrna expression finishing cattle[D]. Nanjing: Nanjing Agricultural University, 2014. (in Chinese) [33] 郭朝龙. 泌乳奶山羊对赖氨酸梯度缺失的代谢及代谢调节反应研究[D]. 泰安: 山东农业大学, 2014. GUO C L. Study on metabolism and metabolism regulation of lactating goats with lysine gradient deficiency[D]. Taian: Shandong Agricultural, 2014. (in Chinese) [34] 高景, 齐智利. 瘤胃上皮短链脂肪酸的吸收和代谢. 动物营养学报, 2018, 30(4): 1271-1278. GAO J, QI Z L. Absorption and metabolism of short chain fatty acids in ruminal epithelium. Chinese Journal of Animal Nutrition, 2018, 30(4): 1271-1278. (in Chinese) [35] 陈俊宏, 赵芳, 魏凯敏, 谭世新, 杨开伦. 添喂色氨酸、过瘤胃色氨酸对奶牛泌乳性能、血浆指标和乳中褪黑素含量的影响. 动物营养学报, 2017, 29(11): 3921-3931. CHEN J H, ZHAO F, WEI K M, TAN S X, YANG K L. Effects of tryptophan and rumen-protected tryptophan supplementations on lactation performance, plasma indexes and milk melatonin content of dairy cows. Chinese Journal of Animal Nutrition, 2017, 29(11): 3921-3931. (in Chinese) [36] ARDALAN M, REZAYAZDI K, DEHGHAN-BANADAKY M. Effect of rumen-protected choline and methionine on physiological and metabolic disorders and reproductive indices of dairy cows. Journal of Animal Physiology and Animal Nutrition, 2010, 94(6): 259-265. [37] LAVEN R A, LIVESEY C T. The effect of housing and methionine intake on hoof horn hemorrhages in primiparous lactating holstein cows. Journal of Dairy Science, 2004, 87(4): 1015-1023. [38] 高岩, 吴健豪, 曲永利, 潘琪琪, 张士博, 韩天龙, 王志博, 殷溪瀚.饲粮中添加过瘤胃蛋氨酸、过瘤胃赖氨酸对荷斯坦奶公牛肉用生产性能和肉品质的影响. 动物营养学报, 2016, 28(9): 2936-2942. GAO Y, WU J H, QU Y L, PAN Q Q, ZHANG S B, HAN T L, WANG Z B, YIN X H. Effects of rumen-protected methionine and rumen-protected lysine supplementations in diets on meat production performance and meat quality of holstein bulls. Chinese Journal of Animal Nutrition, 2016, 28(9): 2936-2942. (in Chinese) [39] HUSSEIN A H, BATISTA E D, MIESNER M D, TITGEMEYER E C. Effect of ruminal ammonia supply on lysine utilization by growing steers. Journal of Animal Science, 2016, 94(2): 656-664. [40] HILL T M,QUIGLEY J D,BATEMAN H G,ALDRICH J M, SCHLOTTERBECK R L. Source of carbohydrate and metabolizable lysine and methionine in the diet of recently weaned dairy calves on digestion and growth. Journal of Dairy Science, 2016, 99(4): 2788-2796. [41] SAI S. Effect of supplementation of rumen protected methionine plus lysine on growth performance, nutrient utilization and some blood metabolites in calves//Meeting of the Northwest Section of the Aps. American Physical Society, 2013. [42] 苏鹏程, 卢德勋, 孙海洲, 卢媛, 牛文艺, 赵秀英, 珊丹, 李京淑. 在氨基酸平衡饲粮内不同代谢葡萄糖水平对绒山羊小肠氨基酸表观消化率的影响. 动物营养学报, 2005, 17(3): 36-40. SU P C, LU D X, SUN H Z, LU Y, NIU W Y, ZHAO X Y, SHAN D, LI J S. Effect of different dietary metabolizable glucose levels in an amino acids balanced diet on apparent digestibility of amino acids in small intestine of cashmere goats. Chinese Journal of Animal Nutrition, 2005, 17(3): 36-40. (in Chinese) [43] 腾旭, 徐国恒. 葡萄糖与氨基酸的跨膜转运机制. 生物学通报, 2007, 42(9): 23-24. TENG X, XU G H. Mechanism of glucose and amino acids transport through cellular membrane. Bulletin of Biology, 2007, 42(9): 23-24. (in Chinese) [44] DAI Z L, LI X L, XI P B, ZHANG J, WU G Y, ZHU W Y. Metabolism of select amino acids in bacteria from the pig small intestine. Amino Acids, 2012, 42(5): 1597-1608. [45] COLUMBUS D A, CANT J P, DE LANGE C F M. Estimating fermentative amino acid catabolism in the small intestine of growing pigs. animal, 2015, 9(11): 1769-1777. [46] KIM H, MENDEZ R, CHEN X, FANG D Y, ZHANG K Z. Lysine acetylation of CREBH regulates fasting-induced hepatic lipid metabolism. Molecular and Cellular Biology, 2015, 35(24): 4121-4134. [47] 沈佳佳, 闻浩. 蛋白质赖氨酸琥珀酰化修饰研究进展. 医学研究生学报, 2016, 29(3): 332-336. SHEN J J, WEN H. The research progress of protein lysine succinylation. Journal of Medical Postgraduates, 2016, 29(3): 332-336. (in Chinese) [48] 李俊明, 贺强, 袁超, 邹晓庭. 苏氨酸的营养生理功能及其在畜禽日粮中的应用. 中国饲料, 2014(11): 35-38. LI J M, HE Q, YUAN C, ZOU X T. Nutrition and physiological function of threonine and its application in livestock and poultry diet. China Feed, 2014(11): 35-38. (in Chinese) [49] 栾玉静, 杨在宾, 姜淑贞, 张崇玉, 于玲玲, 张桂国. 不同水平赖氨酸对肉牛瘤胃营养物质代谢规律的影响. 中国草食动物科学, 2004, 24(4): 3-5. LUAN Y J, YANG Z B, JIANG S Z, ZHANG C Y, YU L L, ZHANG G G. Effects of different lysine levels on nutrient metabolism of rumen in beef cattle.China Herbivore Science, 2004, 24(4): 3-5. (in Chinese) [50] ALFERINK S J J, VAN DEN BORNE J J G C, HABET A, JACOBS A A A, GERRITS W J J. Intravenous administration of lysine and threonine to a deficient diet results in low nitrogen utilization in preruminant calves. Journal of Orthoptera Research, 2007, 10: 25-37. [51] PAREKH P. Cloning of wheat germ eukaryotic initiation factor eIF2[D]. Austin: University of Texas at Austin, 2009. [52] SHIN B S,KIM J R,WALKER S E, DONG J, LORSCH J R, DEVER T E. Initiation factor eIF2γ promotes eIF2-GTP-Met-tRNAMet ternary complex binding to the 40S ribosome. Nature Structural and Molecular Biology, 2011, 18(11): 1227-1234. [53] BJORDAL M, ARQUIER N, KNIAZEFF J, PIN J P, LEOPOLD P. Sensing of amino acids in a dopaminergic circuitry promotes rejection of an incomplete diet in Drosophila. Cell, 2014, 156(3): 510-521. Effects of Amino Acid Deficiency on Growth Development, Dietary Nutrients Digestion and Metabolism in HeifersKONG FanLin1, LI Yuan1, TANG MengQi2, MA ManPeng1, FU Tong2, DIAO QiYu1, CHENG SiYuan1, TU Yan1 (1Feed Research Institute, Chinese Academy of Agricultural Sciences/Beijing Key Laboratory for Dairy Cow Nutrition, Beijing 100081; 2College of Animal Science and Veterinary Medicine, Henan Agricultural University, Zhengzhou 450000) Abstract:【Objective】The objective of this study was to evaluate the effects of deleting dietary lysine (Lys), methionine (Met) and threonine (Thr) on growth performance, and nutrients digestion and metabolism in 3-6 month-old Chinese Holstein heifers. It can provide not only the evidences for diagnosing the deficiency disease of amino acid of heifers in production, but also the guidance for determining amino acid requirements of heifers in the future.【Method】The experiment was conducted for 90 days with 72 Holstein heifers aged about 84 day-old fed in restricted amounts. Following a 7-day covariate period, heifers were allocated to 4 groups according to date of birth and body weight: 30% Lys reducing treatment (PC-Lys), 30% Met reducing treatment (PC-Met), 30% Thr reducing treatment (PC-Thr) and theoretical amino acid balanced treatment (PC). Body weight, body size and length of nipples were measured on 1, 30, 60 and 90 day. Six healthy calves were selected from each group at the ages of 132-138 and 173-179 day for twice and metabolism test. Feces, urine and feeds samples were collected to determine the apparent digestibility of nutrients and nitrogen metabolism. Dry matter intake was recorded daily throughout the whole trial period. 【Result】Compared with PC, the results showed that (1) Lys deficiency significantly decreased Gain/Feed (G/F) in 90 to 180 day-old heifers (P<0.05). Average daily gain (ADG) of PC-Lys group was lowest among four groups in 90 to 180 day-old heifers (P>0.05). ADG and G/F were not influenced by Met and Thr deficiency in 90 to 180 day-old heifers (P>0.05); (2) No differences of diarrhea rate were found among four groups (P>0.05), while diarrhea rate was highest in PC-Lys group (P>0.05). However, Lys and Thr deficiency decreased fecal score (P<0.05); (3) Lys, Met and Thr deficiency did not affect body size (P>0.05), but the growth rate of nipples of PC-Lys group were lower than that of PC group (P<0.05); (4) The apparent digestibility of nutrients were not influenced by different treatments. Retained N of intake N and biological value of N were significantly decreased in PC-Lys group (P<0.05). 【Conclusion】On the basis of the theoretical amino acid balanced diet, reducing 30% dietary Lys had adverse effect on growth performance and nitrogen metabolism, and reducing 30% dietary Thr could deteriorate diarrhea, while reducing 30% dietary Met had no effects in heifers. Key words:Lys; Met; Thr; heifers; growth performance; nitrogen metabolism doi: 10.3864/j.issn.0578-1752.2020.02.016 开放科学(资源服务)标识码(OSID): 收稿日期:2019-06-24; 接受日期:2019-09-04 基金项目:奶牛产业技术体系北京市创新团队(BAIC06-2017)、中国农业科学院科技创新工程协同创新任务(CAAS-XTCX2016011-01)、河南省科技开放合作项目(182106000035) (责任编辑 林鉴非)
|  |Archiver|手机版|小黑屋|www.openhelp100.com
( 冀ICP备19026749号-1 )
|Archiver|手机版|小黑屋|www.openhelp100.com
( 冀ICP备19026749号-1 )