|
超高压及三聚磷酸钠质量分数对肌球蛋白凝胶保水性及热胶凝过程的影响超高压及三聚磷酸钠质量分数对肌球蛋白凝胶保水性及热胶凝过程的影响 钱 畅,薛思雯,徐幸莲*,周光宏* (南京农业大学 国家肉品质量安全控制工程技术研究中心,肉品加工与质量控制教育部重点实验室,农业部畜产品加工重点实验室,江苏高校肉类生产与加工质量安全控制协同创新中心,江苏 南京 210095) 摘 要: 为探究超高压处理及三聚磷酸钠质量分数对肌球蛋白凝胶保水性及热胶凝过程的影响,在不同压力条件(100、200、300 MPa)下对添加不同质量分数(0%、0.15%、0.30%、0.45%)三聚磷酸钠的兔骨骼肌肌球蛋白进行25 ℃、9 min超高压处理后再经程序升温(1 ℃/min)制备凝胶,以未经超高压处理的含质量分数0.30%三聚磷酸钠的肌球蛋白为对照组,测定凝胶的保水性,并筛选出对其有显著影响的参数组合。在该条件下对蛋白的溶解度、ATP酶活力和升温过程中的蛋白二级结构含量、表面疏水性、活性巯基含量、静态流变性以及凝胶微观结构等指标进行测定。结果显示:含质量分数0.15%三聚磷酸钠的肌球蛋白经不高于200 MPa的超高压处理后,其溶解度显著下降,ATP酶活力显著上升(P<0.05);质量分数0.15%三聚磷酸钠对超高压处理诱导的肌球蛋白功能特性变化存在拮抗作用,且蛋白在升温过程中的变性、聚集受抑制,随着三聚磷酸钠质量分数升高到0.30%,拮抗作用消失,蛋白在热胶凝过程中结构充分展开,疏水基团与所包埋的巯基快速暴露,形成的凝胶结构富有弹性且致密有序,保水性显著提高(P<0.05);而300 MPa超高压处理使蛋白的ATP酶活力丧失,溶解度及热变性程度降低,分子间交联弱化,最终使凝胶保水性显著下降(P<0.05)。三聚磷酸钠通过影响蛋白的结构与理化特性,改变其热凝胶形成过程中的变性速率与交联方式,导致最终凝胶保水性发生变化。 关键词:肌球蛋白;超高压;三聚磷酸钠;保水性;凝胶 三聚磷酸钠作为肉制品加工中常用的品质改良剂,能通过改变体系电荷密度的方式促进肌原纤维蛋白的溶解及肌纤维的横向膨胀,从而提高肉及肉制品的保水性[1];其还能水解产生焦磷酸钠,从而使肌动球蛋白解离并提高肌球蛋白的溶解度和提取率[2]。然而,有研究指出,过量摄入磷酸盐会增加肾脏的代谢压力并引发诸多疾病[3]。这就要求加工者在保持产品原有性状的同时尽可能地降低三聚磷酸钠的添加量。超高压加工技术可以通过影响盐离子对蛋白的修饰作用,促进其溶解并增强其水合能力,从而降低肉制品中磷酸盐的含量,但其作用效果受作用压力及蛋白种类的影响[4-5],这说明在高压条件下磷酸盐对蛋白的作用机制尚不清晰,需要进一步研究。 保水性是评价肉及肉制品品质的重要指标之一,而肌球蛋白作为肌肉蛋白中占比最高(约25%)且唯一能形成热凝胶的蛋白[6],对此起决定性作用。单体肌球蛋白具有不对称的分子结构(包含双头球状、杆状与尾部结构域),其头部有ATP酶的活性位点,尾部主要由α-螺旋组成[6]。在加热过程中蛋白变性,分子结构展开,因聚合作用形成凝聚体,并最终交联形成凝胶网络结构。而在此过程中蛋白结构的展开程度、变性和聚集的速度以及多聚体之间的相互作用等均会影响有序凝胶网络的形成,并最终改变凝胶的保水性[7]。有学者发现加入氯化钠和磷酸盐会分别使蛋白结构域的转变温度明显升高或降低,从而改变蛋白的热稳定性[8-9]。Speroni等[10]则发现三聚磷酸钠对高压肌球蛋白热变性过程的影响会随其质量分数和作用压力的变化而变化。更有研究认为加入到纯肌球蛋白体系中的三聚磷酸钠会改变蛋白的ATP酶活力[11],从而影响蛋白的热胶凝过程与形成凝胶的性质。但具体作用方式仍缺乏合理解释,因此还需进行细致深入的研究。 本研究对含不同质量分数三聚磷酸钠的兔骨骼肌肌球蛋白进行超高压处理后程序升温,筛选出对蛋白凝胶保水性有显著影响的压力参数与三聚磷酸钠质量分数的组合;在该条件下进一步研究超高压处理和三聚磷酸钠质量分数对蛋白溶解度、ATP酶活力和升温过程中蛋白的二级结构含量、表面疏水性、活性巯基含量、静态流变性及所形成热凝胶的微观结构等理化特性的影响。探讨凝胶保水性差异的形成原因及磷酸盐在高压肌球蛋白体系中的作用机制,为低磷酸盐健康肉制品的开发提供理论参考。 贮藏过程中,随着肉组织结构的分解,肉的持水力下降,会造成肉的重量下降、品质降低。本研究结果(见表3)表明:随着贮藏时间的增加,A组处理的汁液损失率最高,为2.32%,C组其次1.72%,B组为1.64%。 1 材料与方法1.1 动物、材料与试剂3 月龄雄性新西兰白兔(2.5~3.0 kg)江苏省农科院畜牧所;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、腺苷-5’-三磷酸二钠盐(adenosine triphosphate,ATP)、二硫苏糖醇(DL-dithiothreitol,DTT)、溴酚蓝、β-巯基乙醇(均为色谱纯) 美国Sigma公司;牛血清白蛋白(bovine serum albumin,BSA)、超微量Ca2+-ATP酶测定试剂盒 南京建成生物科技有限公司;氯化钠、焦磷酸钠、三聚磷酸钠、氯化钾、磷酸氢二钾、磷酸二氢钾(均为分析纯) 南京化学试剂公司;5,5’-二硫基双-2-硝基苯甲酸(5,5’-dithiobis-2-nitroben-zoic acid,DTNB)、8-苯胺基-1-萘磺酸(1-anilinonaphthalene-8-sulphonic acid,ANS)(均为分析纯) 上海阿拉丁生化科技股份有限公司;聚乙烯真空包装袋(20 ℃时透氧率为1 cm3/(m2·h)) 南京瑞翼特生物科技有限公司;MD44 36 mm透析袋(截留分子质量为3 500 Da) 合肥新恩源生物技术有限公司。 1.2 仪器与设备Waring高速组织捣碎机 美国思伯明设备有限公司;Ultra Turrax T25高速匀浆器 德国IKA公司;Avanti J-E高速冷冻离心机 美国贝克曼有限公司;MiniProtean3Cell小型垂直电泳槽、PowerPac Basic电泳仪美国Bio-Rad公司;TY-80s脱色摇床 南京大学南达生物技术有限公司;GT-800F凝胶成像系统 日本爱普生公司;S-3000N扫描电子显微镜 日本日立公司;MCR 301流变仪 奥地利Physica公司;Spectra Max M2酶标仪 美国分子设备有限公司;圆二色光谱仪英国Applied Physics有限公司;S-IL-100-850-9-W高压设备 英国Stansted Fluid Power公司。 1.3 方法1.3.1 肌球蛋白的提取、检测与蛋白样品的制备 选用健康的新西兰雄性白兔,宰前饮水和休息,减少应激。机械击昏后切断颈部血管放血,迅速剥皮,去头、爪及内脏,自来水冲洗去除血迹。沥干后放入4 ℃冰箱15 min,取腰大肌并剔除可见脂肪及结缔组织,切碎。参照Cao Yingying等[12]的操作,于0~4 ℃下提取肌球蛋白,蛋白样品采用SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)进行检测分析。SDS-PAGE条件:分离胶质量分数10%,浓缩胶质量分数4%,开始电压为80 V,进入分离胶后电压加大至120 V[13-14],肌球蛋白纯度的计算参照Laemmli[15]的方法,通过Quantity One软件分析蛋白特征条带的相对OD值。用双缩脲法检测肌球蛋白质量浓度。 将蛋白样品放入20 cm长的透析袋中,分别置于含不同质量分数(0%、0.15%、0.30%、0.45%)三聚磷酸钠的磷酸盐缓冲液(1%(质量分数,下同)NaCl、20 mmol/L pH 6.5 KH2PO4/K2HPO4)与含0.30%三聚磷酸钠的磷酸盐缓冲液(2% NaCl、20 mmol/L pH 6.5 KH2PO4/K2HPO4)中4 ℃透析20 h,期间每7 h更换1 次透析液,共换3 次。透析完成后再用相应的磷酸盐缓冲液将蛋白样品的质量浓度调节至20 mg/mL。 1.3.2 蛋白样品的超高压处理及热凝胶的制备 用真空包装袋将高压处理组的蛋白样品封装(每袋约50 mL,去除气泡)。根据本实验室前期研究[16-17]得到的高压参数,将蛋白样品分别在100、200、300 MPa下保压9 min,腔体温度为25 ℃。对照组蛋白则置于常压室温((25±1)℃)下9 min。超高压处理完成后,将对照组和高压处理组的蛋白溶液均置于0~4 ℃环境下12 h,待其状态稳定后再用10 mL离心管及玻璃烧杯盛装,并置于水浴锅中从20 ℃程序升温(1 ℃/min)至85 ℃,保温20 min。将凝胶置于0~4 ℃下过夜(12 h)。 1.3.3 蛋白溶解度的测定 参照Chen Xing等[18]的方法并略作改动,用相应的磷酸盐缓冲液将静置12 h后的蛋白溶液稀释至5 mg/mL,在4 ℃下以20 000×g离心20 min,用双缩脲法测定上清液的蛋白质量浓度,实验重复3 次。蛋白溶解度按式(1)计算。 
1.3.4 保水性的测定 参照Kocher等[19]的方法并作适当改动。准确称量加入蛋白溶液前的离心管质量(m1)及加入蛋白溶液后的总质量(m2)。凝胶制备完成后,经4 ℃、8 000×g离心10 min后去除水分,准确称量余下质量(m3),实验重复3 次。保水性按式(2)计算。 
1.3.5 扫描电子显微镜观察 凝胶样品的制备参照徐幸莲[6]的方法,用体积分数4%戊二醛溶液(由25%戊二醛溶液用相应的磷酸盐缓冲液稀释得到)固定48 h,用双面刀片切成均匀小块(3 mm×3 mm×2 mm),再用不同体积分数(50%、70%、90%、95%、100%)的乙醇溶液进行梯度脱水,放入叔丁醇中置换3 次,每次30 min,再将其冷冻干燥并喷金(10 nm)。利用扫描电子显微镜进行观察,加速电压为10 kV,每个样品观察8 个区域。 1.3.6 ATP酶活力的测定 参照田金河[20]的方法,将蛋白样品用相应的磷酸盐缓冲液稀释至0.1 mg/mL,用超微Ca2+-ATP酶测定试剂盒测定ATP酶活力,每个处理组均设置测定管和对照管,其中对照管在酶反应结束后再加入蛋白样品。根据试剂盒操作步骤,采用比色法在636 nm波长处测定ATP酶解反应产生的无机磷物质的量,蛋白的ATP酶活力以ATP酶活力单位表示,即每毫克蛋白每小时分解产生无机磷的物质的量(μmol/(mg·h)),实验重复3 次。 1.3.7 静态流变特性的测定 参照Chen Xing等[18]的方法,将蛋白样品用相应的磷酸盐缓冲液稀释至5 mg/mL。仪器采用平行板(上板直径50 mm),参数设置如下:频率为0.1 Hz,应变为0.01%,狭缝宽度为0.5 mm,从20 ℃以1 ℃/min升温至80 ℃,记录储能模量(G’)的变化情况。 1.3.8 蛋白质二级结构含量的测定 参照薛思雯等[21]的方法,测定蛋白质在升温过程中二级结构含量的变化。将蛋白样品用相应的磷酸盐缓冲液稀释至0.3 mg/mL,在200~260 nm波长范围内测量分子椭圆率,采用20~90 ℃程序升温(1 ℃/min),计算25、40、55、70、85 ℃下肌球蛋白分子二级结构(α-螺旋、β-折叠、β-转角以及无规卷曲)的含量。 1.3.9 表面疏水性的测定 参照Chen Xing等[18]的方法并作适当修改,以ANS为荧光探针测定蛋白升温过程中的表面疏水性变化。将蛋白样品用相应的磷酸盐缓冲液稀释至1 mg/mL,各取4 mL稀释蛋白液加入10 mL离心管中,每个处理组含15 个样品,用于在25、40、55、70、85 ℃下的表面疏水性测定。将样品置于水浴锅中,从20~85 ℃程序升温(1 ℃/min),并在5个特定温度下保温5 min,后将对应的样品取出冰浴,防止温度对蛋白的进一步影响。向冷却至室温后的蛋白液中加入20 μL ANS溶液(15 mmol/L ANS溶解于0.1 mol/L pH 7.0磷酸盐缓冲液),室温下反应20 min后使用酶标仪检测激发波长为375 nm、发射波长为470 nm条件下的荧光强度,以其表征蛋白的表面疏水性,实验重复3 次。 1.3.10 活性巯基含量的测定 参照Ellman[22]的方法并作适当修改,利用DTNB测定蛋白升温过程中的活性巯基含量变化,蛋白样品制备及升温过程同1.3.9节。向冷却后的蛋白液中加入20 μL DTNB溶液(10 mmol/L DTNB溶解于0.1 mol/L pH 7.0磷酸钾缓冲液)。混匀后在暗处4 ℃反应1 h,取上清液并用酶标仪测定其在412 nm波长处的吸光度,并按式(3)计算蛋白中活性巯基的含量(C0),实验重复3 次。 
式中:A412 nm为412 nm波长处吸光度;ε为摩尔吸光系数(13 600 L/(mol·cm));D为稀释倍数;ρ为肌球蛋白质量浓度/(mg/mL)。 2.本科学习成绩与因变量之间是呈同向变化,本科学习成绩越好,表明学生学习能力、学习兴趣越高,考上的概率越大,因此选择考研的概率也就越高。据相关研究发现,“这些考上硕士研究生的学生大学四年学习综合成绩普遍比较好,学习成绩班级平均排名在1-5名区间的,比例高达74%”。﹝2﹞ 1.4 数据统计分析实验数据均以 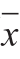 ±s表示。用SAS V8软件进行数据分析,超高压作用压力和三聚磷酸钠质量分数的主效应及超高压作用压力×三聚磷酸钠质量分数的交互作用由混合模型方差程序进行分析,差异显著性用邓肯氏多重比较(Duncan’s)分析,P<0.05时表示差异显著。 如图1所示,经测定,肌球蛋白重链分子质量约为207 kDa,3 条轻链的分子质量分别为18.5、10 kDa和8 kDa,与文献[23]的报道基本一致,经Quantity One软件分析计算,肌球蛋白纯度约为83%。  图1 肌球蛋白提取产物SDS-PAGE图
Fig.1 SDS-PAGE prof i le of the extracted myosin from rabbit skeletal muscle
2.2 凝胶保水性结果分析 图2 超高压作用压力和三聚磷酸钠质量分数对肌球蛋白热凝胶保水性的影响
Fig.2 Effects of UHP and STPP content on WHC of heat-induced myosin gels
肌肉蛋白凝胶的保水性能够直接影响重组类肉制品的感官特性和出品率,是衡量产品品质的一项重要指标[24]。从图2中可以看出,经100、200 MPa超高压处理的蛋白加热后形成的凝胶的保水性较对照组显著升高(P<0.05),在300 MPa时则大幅下降(P<0.05),这与曹莹莹等[25]的研究结果相符。作用于蛋白的外部压力会影响其分子形态和分子间的相互作用,并改变其凝胶形成过程。有研究报道,200 MPa以下的超高压处理会促进蛋白构象的展开与分子间作用力的形成,强化蛋白与水间的相互作用[26];而300 MPa以上的超高压处理会使蛋白过度变性,弱化其凝胶形成能力,导致凝胶保水性下降[16]。 含0.15%三聚磷酸钠的蛋白经100、200 MPa超高压处理后加热形成的凝胶的保水性显著下降(P<0.05)。但随着三聚磷酸钠质量分数升高到0.30%,凝胶保水性再次上升,且高于未添加三聚磷酸钠的处理组,此后无显著变化(P>0.05)。徐幸莲[6]则发现三聚磷酸钠仅在质量分数达0.75%以上时才会起到提高凝胶保水性的作用。改善凝胶保水性所需的三聚磷酸钠添加量的差异可能是超高压处理以及试剂添加方式上的不同所致。蛋白凝胶的保水性与蛋白的溶解度、分子间作用力以及凝胶的微观结构息息相关。有学者认为,加入到纯肌球蛋白体系中的磷酸盐对体系环境和蛋白热胶凝过程的影响可能改变凝胶结构,从而导致凝胶保水性的变化[27]。随着三聚磷酸钠质量分数的增大,经300 MPa处理的蛋白加热形成的凝胶的保水性也持续上升,可能是剧烈的压力作用改变了蛋白头部亚基结构[16],磷酸盐对蛋白的作用机制同时也发生变化。 在100~300 MPa的压力范围内,蛋白凝胶的保水性随着三聚磷酸钠质量分数从0%升高到0.30%不断变化,说明在此过程中蛋白的理化特性及热凝胶的形成过程也明显改变,此后三聚磷酸钠质量分数的升高则对保水性无显著影响(P>0.05)。故选择0%、0.15%、0.30%作为三聚磷酸钠质量分数因素的3 个水平,从蛋白的功能特性和分子结构角度进行深入研究,探讨凝胶保水性差异的形成原因。 (3)呼吸道护理:护理人员应密切关注患儿呼吸,因患儿气管细弱,在帮助患儿吸痰时,应使用直径较小,材质柔软的吸管,动作应放轻柔,不可过重,同时,应注意调整负压,保持用时在15s之内,以免损害粘膜,防止出现呼吸暂停的现象。 2.3 蛋白溶解度结果分析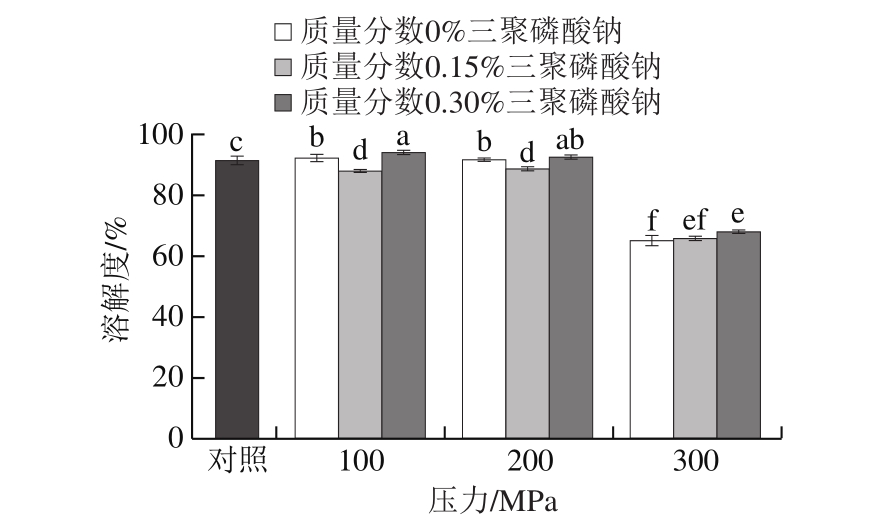 图3 超高压作用压力和三聚磷酸钠质量分数对肌球蛋白溶解度的影响
Fig.3 Effects of UHP and STPP content on solubility of myosin
肌球蛋白是一种盐溶蛋白,在高盐浓度下呈可溶状态[28]。超高压处理可以通过影响盐离子对蛋白的修饰作用促进其溶解,从而增强其凝胶能力[29]。从图3中可以看出,未添加三聚磷酸钠的蛋白经100、200 MPa处理后,其溶解度较对照组显著上升(P<0.05),这与Yamamoto等[30]的研究结果相符。但加入了0.15%三聚磷酸钠的蛋白经超高压处理后,其溶解度较对照组明显降低(P<0.05)。徐幸莲[6]也报道了在低离子强度体系中,加入0.25%三聚磷酸钠会导致溶液浊度显著上升。当三聚磷酸钠质量分数升高到0.30%时,蛋白的溶解度再次上升,并显著高于未添加三聚磷酸钠的处理组(P<0.05),其中以经100 MPa超高压处理的含0.3%三聚磷酸钠的蛋白的溶解度最高。这说明当质量分数较低时,三聚磷酸钠会呈现出对高压促溶效应的拮抗作用。而随着添加量的增大,这种拮抗作用逐渐消失,蛋白的亲水作用加强,溶解度提高。当压力升高到300 MPa时,蛋白的溶解度显著下降(P<0.05)。这与文献[31]的报道相符,说明剧烈的压力作用加剧了疏水基团的暴露[32],疏水相互作用的增强促进了蛋白分子的聚集[33]。 2.4 ATP酶活力结果分析 图1 超高压作用压力和三聚磷酸钠质量分数对高压肌球蛋白ATP酶活力的影响
Fig.1 Effects of UHP and STPP content on ATPase activity of myosin
肌球蛋白的ATP酶活力与其构象紧密相关,故常作为衡量蛋白变性程度的一项指标[34]。从图4中可以看出,与对照组相比,经超高压处理后未添加三聚磷酸钠的蛋白的ATP酶活力显著降低(P<0.05),且随着作用压力的升高不断下降,300 MPa时各处理组蛋白的ATP酶活力接近于0。这与Yamamoto[35]和Iwasaki[36]等的研究结果相符,说明超高压处理会使肌球蛋白的ATP酶活力降低乃至丧失。ATP酶的结合位点位于蛋白头部的S-1亚基上,其活性中心是半胱氨酸的巯基[24],超高压处理破坏了蛋白的天然结构,促使其头部亚基解离并在疏水作用的参与下进一步聚集[26]。这会导致酶的结合位点或活性中心被包裹或遮蔽,其活力也随之下降[35]。300 MPa时蛋白ATP酶活力的丧失也说明其头部变性的程度较高,与前人的研究结果[17]吻合。 含0.15%三聚磷酸钠的蛋白经100、200 MPa超高压处理后,其ATP酶活力显著升高(P<0.05),说明低质量分数(0.15%)的三聚磷酸钠对超高压诱导蛋白头部变性有拮抗作用。但三聚磷酸钠质量分数升高到0.30%后,蛋白的ATP酶活力显著下降(P<0.05),说明蛋白头部的变性程度再次增大。许多学者研究发现ATP和三聚磷酸钠均能与肌球蛋白头部S-1亚基结合[27,37],且两者的磷酸基团连接方式相同,具有结构相似性[38]。Blum[39]认为三聚磷酸钠可能与肌球蛋白的ATP酶位点间存在特异性结合,并能改变其ATP酶活力。Xiong Youling L.等[2]则认为ATP酶具有水解三聚磷酸钠的能力。Jin Hongguo等[40]发现肌球蛋白的S-1亚基同时具有ATP酶和三聚磷酸酶活力,但两者的活性中心并不相同,且三聚磷酸酶的活力更高。综合已有的研究及本实验的结果,推测在三聚磷酸钠质量分数较低时,它会与三聚磷酸酶的活性中心发生特异性结合;但由于三聚磷酸钠与ATP的结构相似,处于同一结构域的ATP酶的活性位点同时也会被诱导暴露或活化,从而导致ATP酶活力的升高。随着三聚磷酸钠质量分数的上升,多余的三聚磷酸钠无法与相应的酶位点结合并水解(受位点数量及水解反应速率的限制)[11,41],只能发生电离,因此体系的离子强度增大且pH值升高。林丽军[42]的研究显示肌球蛋白的ATP酶活力在低离子强度和pH 5.5环境中达到最高,但随着离子强度和pH值的升高而下降,故蛋白的ATP酶活力在三聚磷酸钠质量分数升高到0.30%时再次下降。 2.5 表面疏水性和活性巯基含量结果分析表1 超高压作用压力和三聚磷酸钠质量分数对肌球蛋白升温过程中表面疏水性的影响
Table1 Effects of UHP and STPP content on surface hydrophobicity of myosin during heating 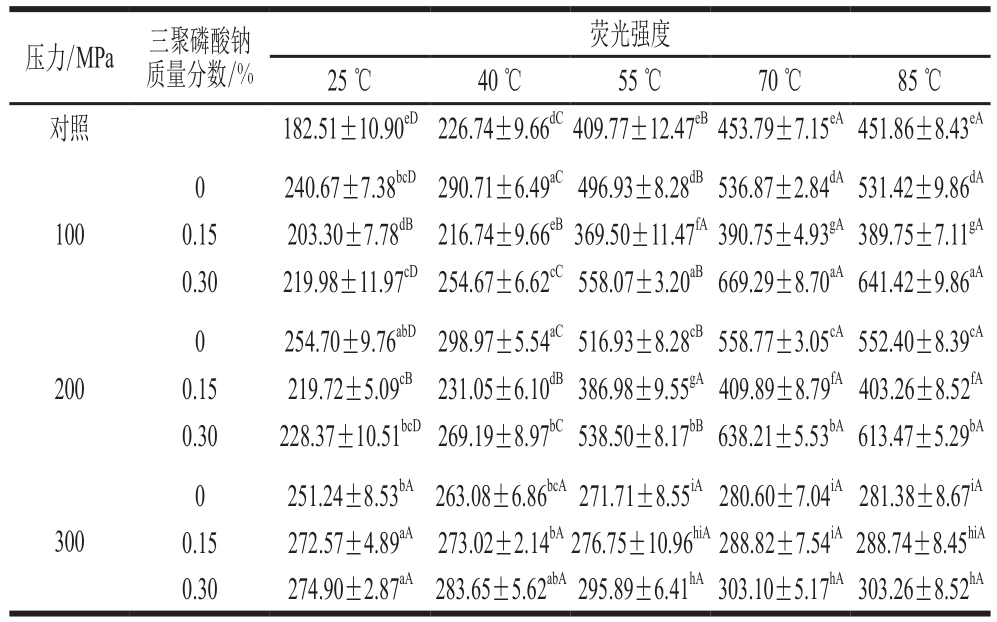 注:小写字母不同表示同一指标相同温度下不同压力间差异显著(P<0.05);大写字母不同表示同一指标相同压力和三聚磷酸钠质量分数下不同温度间差异显著(P<0.05)。表2同。 压力/MPa 三聚磷酸钠质量分数/%荧光强度25 ℃ 40 ℃ 55 ℃ 70 ℃ 85 ℃对照 182.51±10.90eD226.74±9.66dC409.77±12.47eB453.79±7.15eA451.86±8.43eA 100 0 240.67±7.38bcD 290.71±6.49aC496.93±8.28dB536.87±2.84dA531.42±9.86dA 0.15 203.30±7.78dB 216.74±9.66eB369.50±11.47fA390.75±4.93gA389.75±7.11gA 0.30 219.98±11.97cD254.67±6.62cC558.07±3.20aB669.29±8.70aA641.42±9.86aA 200 0 254.70±9.76abD 298.97±5.54aC516.93±8.28cB558.77±3.05cA552.40±8.39cA 0.15 219.72±5.09cB 231.05±6.10dB386.98±9.55gA409.89±8.79fA403.26±8.52fA 0.30 228.37±10.51bcD269.19±8.97bC538.50±8.17bB638.21±5.53bA613.47±5.29bA 0 251.24±8.53bA 263.08±6.86bcA271.71±8.55iA280.60±7.04iA281.38±8.67iA 0.15 272.57±4.89aA 273.02±2.14bA276.75±10.96hiA288.82±7.54iA288.74±8.45hiA 0.30 274.90±2.87aA 283.65±5.62abA295.89±6.41hA303.10±5.17hA303.26±8.52hA 300
表2 超高压作用压力和三聚磷酸钠质量分数对肌球蛋白升温过程中活性巯基含量的影响
Table2 Effects of UHP and STPP content on reactive sulfhydryl group content of myosin during heating  压力/MPa 三聚磷酸钠质量分数/%活性巯基含量/(μmol/100 mg)25 ℃ 40 ℃ 55 ℃ 70 ℃ 85 ℃对照 114.61±4.22hC 138.92±4.42eC 217.40±4.12eB 257.75±2.50fA 267.55±5.83fA 100 0 227.65±8.48dC 250.34±3.82cC 365.93±6.18cB 416.37±5.17cA 412.30±3.53cA 0.15 127.99±1.40gB 147.84±1.56eB 205.29±4.86eA 233.97±9.22gA242.94±4.27gA 0.30 192.84±3.06eD235.20±5.61dC444.07±5.96aB 496.96±4.56aA487.11±3.03aA 200 0 245.39±3.74cC 262.60±2.78cC 387.40±3.33bB439.61±7.83bA436.37±5.75bA 0.15 145.00±1.85fB 158.92±4.42eB 217.40±4.12eA 233.58±2.35gA233.24±5.69gA 0.30 216.47±8.58dD 257.25±4.81cC 454.26±8.53aB 504.71±9.82aA 498.33±6.01aA 300 0 299.22±9.14bB 304.46±4.00bB346.27±7.37dA 357.11±5.92dA 362.45±7.40dA 0.15 318.82±2.96aB 317.94±4.06aB 350.15±2.53dA364.63±3.38dA368.24±4.93dA 0.30 322.74±1.32aA 328.53±3.76aA354.90±4.08cdA370.54±3.49dA378.04±0.45dA
疏水基团和巯基在肌球蛋白受热变性凝聚的过程中起重要作用[6]。表1、2分别显示了高压肌球蛋白在升温过程中疏水基团和包埋巯基基团的暴露情况。可以看出,与对照组相比,经超高压处理后未添加三聚磷酸钠的蛋白在加热前(25 ℃)的表面疏水性和活性巯基含量均显著升高(P<0.05),且随着压力的增大呈上升趋势。这与前人的研究结果一致[12],压力作用会导致部分维持蛋白三级结构稳定性的非共价键断裂,暴露出包埋的氨基酸残基。含0.15%三聚磷酸钠的蛋白经100、200 MPa处理后,其表面疏水性和活性巯基含量显著低于其他两组(P<0.05),说明低质量分数的三聚磷酸钠会拮抗超高压处理对蛋白分子构象的改变。Fernández-Martin等[43]也认为磷酸盐的加入会削弱高压处理后蛋白分子间形成的疏水相互作用。随着三聚磷酸钠质量分数进一步升高,蛋白在加热前的表面疏水性和活性巯基含量再次显著上升(P<0.05),说明磷酸盐对超高压处理的拮抗作用逐渐消失,蛋白的三级结构发生变化。 当温度升高到40 ℃后,100、200 MPa各处理组蛋白的表面疏水性和活性巯基含量均呈显著上升趋势(P<0.05),但变化速率仍有差别。在40~55 ℃的温度区间内,100 MPa 0.30%三聚磷酸钠处理组蛋白的表面疏水性和活性巯基含量的变化速率最高(分别为20.23 ℃-1和13.92 μmol/(100 mg·℃));200 MPa 0.30%三聚磷酸钠处理组其次。而100 MPa 0.15%三聚磷酸钠和200 MPa 0.15%三聚磷酸钠处理组的变化速率则是同压力处理组中最低的,且其蛋白的的表面疏水性和活性巯基含量在55 ℃后无显著变化(P>0.05)。这说明低质量分数的三聚磷酸钠会抑制高压肌球蛋白在加热过程中的三级结构变化以及疏水基团和隐藏巯基的暴露;而三聚磷酸钠质量分数的升高促进了升温过程中蛋白高级构象的展开及所包埋基团的暴露。这也是蛋白形成具有良好保水性的凝胶的关键[7,16],在温度和氧化剂的作用下,蛋白分子间形成疏水相互作用,暴露的巯基也被氧化成二硫键[12]。这有助于蛋白凝聚体及有序凝胶结构的形成,大量的水分子被吸引并被包裹在三维凝胶网络中[16],凝胶的保水性因此上升。300 MPa时各处理组蛋白的表面疏水性和活性巯基含量在加热过程中无明显变化,说明超高压处理使蛋白过度聚集,抑制了蛋白结构内疏水基团和巯基的暴露[16]。 2.6 超高压作用压力、三聚磷酸钠质量分数间的交互作用情况由表3可知,超高压作用压力对加热前的蛋白溶解度以及最终热凝胶保水性有显著影响(P<0.05),对其他指标有极显著影响(P<0.01);三聚磷酸钠质量分数则对所有指标有极显著影响(P<0.01)。这与Villamonte等[4]报道的结果相符,说明超高压作用压力和三聚磷酸钠质量分数的变化均会改变高压肌球蛋白的空间构象,引起蛋白分子间化学作用力的变化,从而影响所形成凝胶的保水性,而两者间的交互作用对各项指标也均有极显著影响(P<0.01),说明不同压力条件下三聚磷酸钠质量分数改变引起的蛋白性质变化也不尽相同。 表3 超高压作用压力、三聚磷酸钠质量分数及其交互作用对肌球蛋白的理化性质和凝胶保水性的影响
Table3 Effects of UHP, STPP content and their interaction on physicochemical properties of myosin and WHC of formed gel 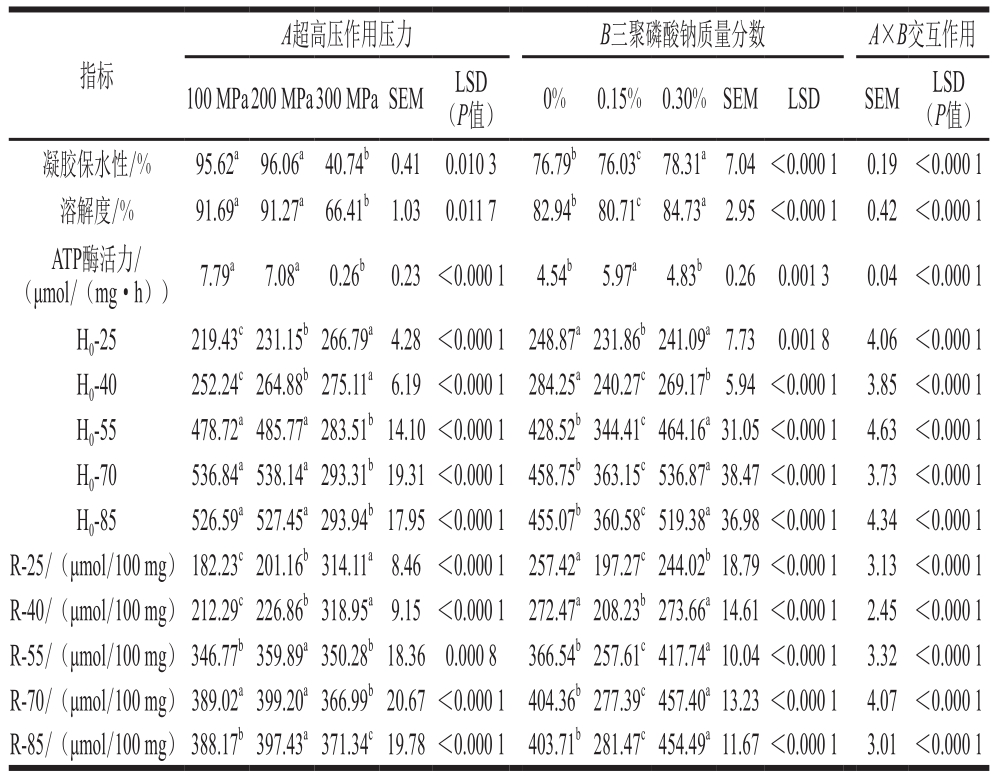 注:小写字母不同表示同行同一因素间差异显著(P<0.05);SEM.标准误差(standard error of mean);LSD.最小显著差异(least signif i cant difference),P<0.01表示差异极显著,P<0.05表示差异显著;H0-25、H0-40、H0-55、H0-70、H0-85和R-25、R-40、R-55、R-70、R-85.分别代表蛋白在25、40、55、70、85 ℃时的表面疏水性和活性巯基含量。 (P值)0% 0.15% 0.30%SEM LSD SEM LSD(P值)凝胶保水性/% 95.62a96.06a40.74b0.41 0.0103 76.79b76.03c78.31a7.04 <0.0001 0.19 <0.000 1溶解度/% 91.69a91.27a66.41b1.03 0.0117 82.94b80.71c84.73a2.95 <0.0001 0.42 <0.000 1指标A超高压作用压力 B三聚磷酸钠质量分数 A×B交互作用100 MPa200 MPa300 MPa SEM LSD ATP酶活力/(μmol/(mg·h))7.79a 7.08a 0.26b 0.23 <0.0001 4.54b 5.97a 4.83b 0.26 0.0013 0.04 <0.000 1 H0-25 219.43c231.15b266.79a4.28<0.0001 248.87a231.86b241.09a7.73 0.0018 4.06<0.000 1 H0-40 252.24c264.88b275.11a6.19<0.0001 284.25a240.27c269.17b5.94<0.0001 3.85<0.000 1 H0-55 478.72a485.77a283.51b14.10<0.0001 428.52b344.41c464.16a31.05<0.0001 4.63 <0.000 1 H0-70 536.84a538.14a293.31b19.31<0.0001 458.75b363.15c536.87a38.47<0.0001 3.73 <0.000 1 H0-85 526.59a527.45a293.94b17.95<0.0001 455.07b360.58c519.38a36.98<0.0001 4.34 <0.000 1 R-25/(μmol/100 mg) 182.23c201.16b314.11a8.46 <0.0001 257.42a197.27c244.02b18.79 <0.0001 3.13 <0.000 1 R-40/(μmol/100 mg) 212.29c226.86b318.95a9.15 <0.0001 272.47a208.23b273.66a14.61 <0.0001 2.45 <0.000 1 R-55/(μmol/100 mg) 346.77b359.89a350.28b18.36 0.0008 366.54b257.61c417.74a10.04 <0.0001 3.32 <0.000 1 R-70/(μmol/100 mg) 389.02a399.20a366.99b20.67 <0.0001 404.36b277.39c457.40a13.23<0.0001 4.07 <0.000 1 R-85/(μmol/100 mg) 388.17b397.43a371.34c19.78 <0.0001 403.71b281.47c454.49a11.67<0.0001 3.01 <0.000 1
2.7 蛋白二级结构含量分析从表4可以看出,在加热前(25 ℃),经超高压处理的未添加三聚磷酸钠的肌球蛋白中α-螺旋结构含量显著低于对照组(P<0.05),且随着作用压力的升高不断降低。而含0.15%三聚磷酸钠的蛋白经100、200 MPa处理后,其α-螺旋结构含量较不含三聚磷酸钠的处理组显著上升(P<0.05),但在三聚磷酸钠质量分数达到0.30%后再次下降(P<0.05)。压力作用带来的体积压缩会削弱维持α-螺旋结构稳定的分子内氢键和离子键,导致其含量不断下降[44]。有报道称三聚磷酸钠对此有拮抗作用[43]。但随着三聚磷酸钠添加量的升高,离子强度增大,蛋白尾部分子链展开,α-螺旋结构含量再次减小[45]。 随着温度不断上升,各处理组蛋白中α-螺旋结构含量均显著降低(P<0.05),而β-折叠和无规卷曲含量随之升高,其中蛋白二级结构含量在40~55 ℃间的变化幅度最大。在此区间内,100 MPa 0.30%三聚磷酸钠处理组的α-螺旋结构含量的下降速率最高(1.41%/℃),200 MPa 0.30%三聚磷酸钠处理组次之(1.36%/℃),而100 MPa 0.15%三聚磷酸钠和200 MPa 0.15%三聚磷酸钠处理组蛋白的二级结构含量虽呈现类似的变化趋势,但其下降速率降低,说明低质量分数的三聚磷酸钠会抑制加热过程中蛋白二级结构的转变。曾淑薇等[46]的研究发现添加质量分数0.30%以上的磷酸盐会促进蛋白的溶解,增大蛋白分子间空间距离,从而加速蛋白尾部的解螺旋。而蛋白二级结构的转变也促进了其高级结构的改变,并导致蛋白表面疏水性和活性巯基含量的变化。300 MPa时各处理组蛋白的二级结构含量在升温过程中的变化幅度减小,说明蛋白的热敏性降低,蛋白尾部的解折叠程度也下降。这可能与此压力条件下蛋白的过度聚集有关[33]。 表1 超高压作用压力和三聚磷酸钠质量分数对肌球蛋白升温过程中蛋白二级结构含量的影响
Table1 Effects of UHP and STPP content on the contents of secondary structures of myosin during heating  注:对于同一二级结构,同列肩标小写字母不同表示差异显著(P<0.05);同行肩标大写字母不同表示差异显著(P<0.05)。 二级结构 压力/MPa三聚磷酸钠质量分数/% 25 ℃ 40 ℃ 55 ℃ 70 ℃ 85 ℃对照 75.8±0.5aA 72.1±0.3aA 53.2±0.7aB 38.8±0.4bC35.8±0.7bC 100 0 65.2±0.3bA 62.0±0.6cA42.2±0.4bB32.7±0.5cC 30.0±0.5cC 0.15 71.8±0.4aA68.4±0.5bA52.1±0.5aB37.9±0.7bC35.8±0.6bC 0.30 68.6±0.5bA64.8±0.4bcA43.6±0.4bB30.1±0.3cC 27.7±0.4cC α-螺旋含量/%200 0 64.0±0.6bcA62.0±0.6cA44.3±0.5bB32.8±0.6cC 30.3±0.5cC 0.15 70.4±0.4abA67.3±0.7bA 51.0±0.8aB 36.2±0.7bC34.1±0.4bC 0.30 67.3±0.4bA62.9±0.5bcA42.5±0.4bB28.6±0.3cC 27.1±0.2cC 300 0 63.1±0.3cA61.5±0.6cA54.5±0.6aB47.7±0.9aC45.7±0.7aC 0.15 63.2±0.6cA61.1±0.3cA53.1±0.5aB45.8±0.5aC43.7±0.6aC 0.30 66.9±0.4bA64.9±0.5bcA54.5±0.7aB 46.0±0.6aC 42.0±0.6aC对照 4.0±0.3bB 7.0±0.5abB 13.1±0.4aA 15.9±0.4aA 16.4±0.7aA 100 0 8.0±0.7aB 9.4±0.8aB 15.6±0.6aA 17.5±0.6aA 18.8±0.6aA 0.15 4.9±0.4bB 6.3±0.4bBC 9.9±0.3bB 15.0±0.3abA14.9±0.4abA 0.30 6.2±0.5aC 6.9±0.7abC 13.2±0.6aB 18.2±0.6aA 19.2±0.3aA β-折叠含量/%200 0 6.7±0.6aB 7.2±0.7abB10.9±0.4bAB15.0±0.3abA15.6±0.6abA 0.15 6.1±0.4bcC 7.0±0.6abC 11.6±0.8abB16.4±0.5aA 17.5±0.6aA 0.30 7.5±0.6aC 8.3±0.8aC 13.9±0.3aB17.3±0.4aA18.3±0.3aA 300 0 7.0±0.4aB 7.3±0.5aB 9.4±0.8bAB 11.7±0.3bA 12.2±0.5bA 0.15 7.2±0.7aB 8.0±0.6aB 10.1±0.3bAB12.0±0.4bA12.9±0.6bA 0.30 6.6±0.5aB 7.2±0.7abB10.9±0.6bAB13.0±0.8bA13.6±0.3bA对照 8.4±0.4bB 8.6±0.3bB 13.9±0.7bA16.1±0.5bA16.8±0.3bA 100 0 10.9±0.6aB 11.3±0.8aB 17.3±1.1aA 18.9±1.0aA 19.2±0.6aA 0.15 9.9±0.5abC10.4±0.7abC15.2±0.8abB18.4±0.8aA 19.0±0.5aA 0.30 10.1±0.7abC11.2±0.5aC 17.5±1.0aB 20.6±1.1aA 20.8±0.8aA β-转角含量/%200 0 11.5±0.7aC12.1±0.7aC17.7±0.8aB20.4±0.7aA21.2±0.6aA 0.15 10.5±0.6aC 11.5±0.5aC15.5±0.6abB18.5±0.6aA 19.2±0.4aA 0.30 10.8±0.6aC12.0±0.6aC18.1±0.5aB21.6±0.8aA21.8±0.5aA 300 0 12.1±0.3aB13.0±0.6aAB14.9±0.5abA14.4±0.5bA14.7±0.3bA 0.15 11.7±0.4aA12.3±0.4aA14.5±0.4bA14.4±0.4bA14.6±0.4bA 0.30 10.2±0.5abB10.7±0.5aB12.6±0.6bAB15.1±0.6bA16.1±0.5bA对照 11.9±0.4bC12.3±0.5bC19.8±0.7bB29.3±0.8aA31.1±0.4aA 100 0 15.8±0.7aC17.4±0.7aC24.9±1.1aB30.9±0.7aA32.1±0.5aA 0.15 13.4±0.5bC14.9±0.6abC22.9±0.6abB28.8±0.5aA30.3±0.8aA 0.30 15.0±0.6abC17.1±0.5aC 25.8±0.8aB 31.1±0.8aA 32.2±0.4aA无规卷曲含量/%200 0 17.7±0.9aC18.7±0.7aC27.1±0.6aB31.9±0.9aA32.9±0.7aA 0.15 13.0±0.5bC 14.2±0.3bC22.0±0.5abB29.0±0.7aA29.2±0.3abA 0.30 14.4±0.4abC16.8±0.5aC 25.6±0.6aB 32.5±1.1aA 32.8±0.6aA 0 17.9±0.9aC18.3±0.6aBC21.2±0.8bB26.3±0.7bA27.4±0.7bA 0.15 17.9±0.7aC18.6±0.7aBC22.4±0.4abB27.8±0.4aA28.9±0.5abA 0.30 16.3±0.5aC 17.2±0.4aC22.0±0.6abB26.0±0.6bA28.3±0.2abA 300
2.8 蛋白流变特性分析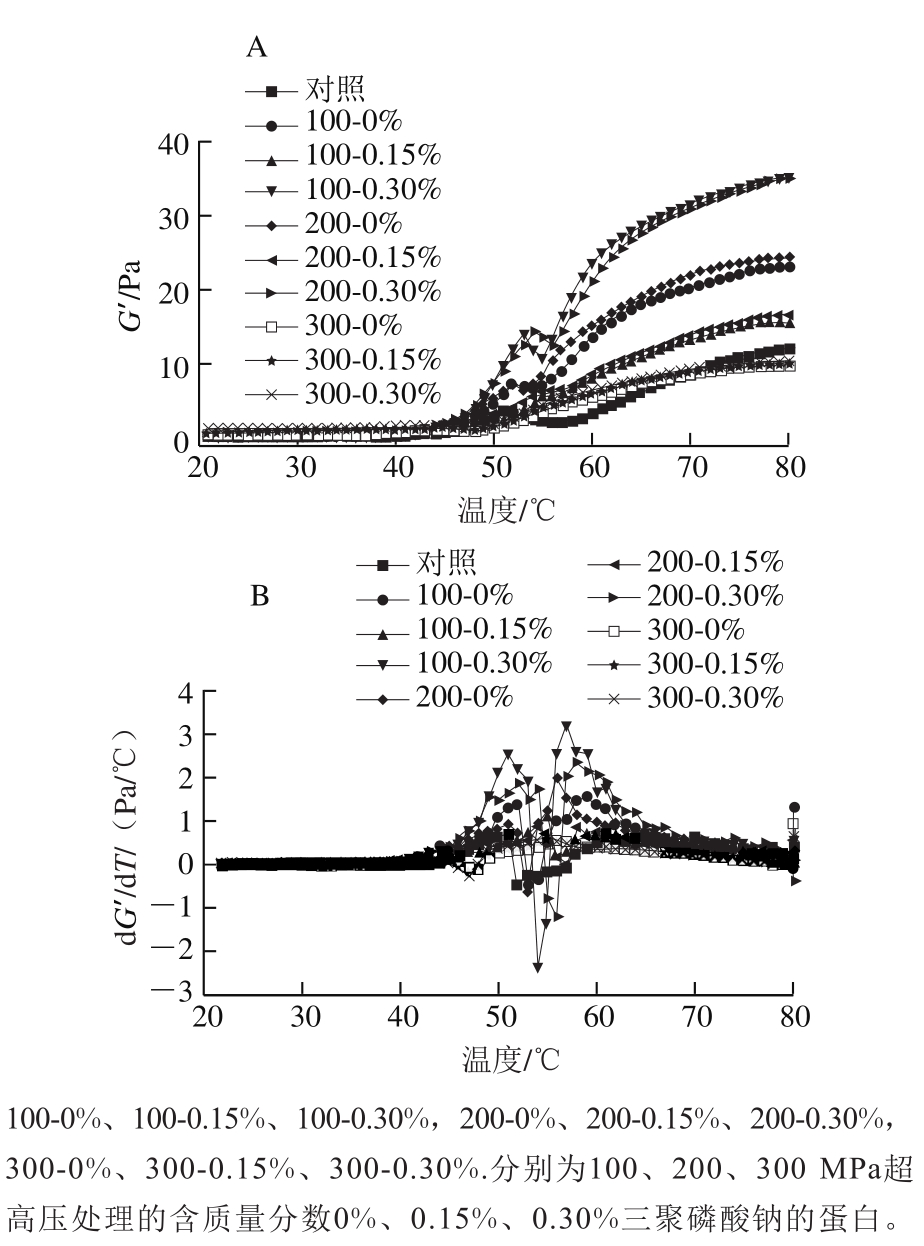 图5 超高压作用压力和三聚磷酸钠质量分数对肌球蛋白升温过程中G’(A)及其变化速率(B)的影响
Fig.5 Effects of UHP and STPP content on G’ (A) and the rate of change in G’ (B) during heating
从图5可以看出,未添加三聚磷酸钠的蛋白经100、200 MPa处理后G’和变化速率dG’/dT的首个峰值温度较对照组均上升了2~3 ℃,这与Liu Gang等[47]的研究结果相符,说明超高压处理使蛋白头部的变性凝聚过程延后,这促进了该部分结构域的展开,有助于蛋白头部亚基的相互结合与聚集[26]。因此G′的首个峰值较对照组有所提升。 含0.15%三聚磷酸钠的蛋白经100、200 MPa超高压处理后再加热,G’与dG’/dT的首个峰值温度较未添加三聚磷酸钠的处理组上升了3 ℃,且G’与dG’/dT的首个峰值也明显降低,说明低质量分数的三聚磷酸钠提升了蛋白头部结构域的热稳定性。文献[48-49]报道了三聚磷酸钠对肌球蛋白热稳定性的增强作用,其多表现为增加最大热吸收峰的温度及变性焓值。Speroni等[10]认为这种保护作用源于磷酸根离子的Hofmeister效应及其与肌球蛋白头部ATP酶位点的特异性结合;Henry[50]和Shriver[51]等的研究则显示磷酸盐会提高蛋白的ATP酶活力并抑制其头部受热变性,从而影响蛋白进一步的凝集。三聚磷酸钠质量分数升高到0.30%时,G’与dG’/dT的首个峰值温度再次下降,且G’与dG’/dT的首个峰值均得到回升,这与Speroni等[10]的研究结果相符,说明蛋白头部的热变性得以恢复乃至被促进。这可能是因为三聚磷酸钠的特异性结合位点饱和,其电离出的磷酸根离子与蛋白侧链上的带电基团结合,破坏了离子键,导致蛋白的热稳定性降低[11]。随着温度升高到55 ℃,100 MPa 0.30%三聚磷酸钠和200 MPa 0.30%三聚磷酸钠处理组蛋白的G’逐渐降低,dG’/dT也出现负峰。说明蛋白尾部结构域的变性打破了之前形成的初步交联结构,蛋白的弹性模量下降[52]。但此时蛋白尾部结构的充分解折叠会促进接下来的尾-尾交联,故60 ℃后含0.30%三聚磷酸钠的蛋白的dG’/dT高于含0.15%三聚磷酸钠的蛋白。100 MPa 0.30%三聚磷酸钠处理组蛋白的最终G′最高,说明其形成的凝胶结构储存弹性形变能量的能力最强。 经300 MPa处理的蛋白在40~55 ℃间无G’及dG’/dT的正峰,说明其头部聚集及弱凝胶形成的阶段消失,这可能与过高的压力导致蛋白头部的聚集能力受损有关[53]。该压力条件下三聚磷酸钠质量分数的变化对G’及dG’/dT的峰值、首个峰值温度以及蛋白的最终G’无明显作用。结合前文ATP酶活力的结果,推测蛋白头部天然构象被破坏从而导致磷酸盐的特异性结合位点消失是其主要原因。 式中,代表干旱增加的强度,Δy代表干旱增加影响指标的变化,我们可以通过这个方法得到各种气候变化对Δx的影响,从而影响到V值的改变,这样我们就能够解决气候变化对脆弱性的影响。 2.9 凝胶微观结构分析 图6 超高压作用压力和三聚磷酸钠质量分数对肌球蛋白热凝胶微观结构的影响
Fig.6 Effects of UHP and STPP content on microstructure of heat-induced myosin gels
图6 是利用扫子显微描电镜观察的高压肌球蛋白热凝胶的微观结构。可以看出,经100 MPa超高压处理的未添加三聚磷酸钠的蛋白加热后形成的凝胶由许多丝状结构交联而成,与对照组相比,其结构中的网孔大小及分布较为均匀,这也与Wang Mengyao等[54]的研究结果一致。而随着0.15%三聚磷酸钠的加入,原本有序的凝胶结构变得杂乱,其中有形状不规则的大孔洞,表面也出现断裂的丝状结构。文献[27]显示低质量分数的三聚磷酸钠会促进蛋白凝聚成交联轴而非颗粒,使交联轴变粗、变大,孔洞增大,凝胶微观结构的致密性下降。而当三聚磷酸钠质量分数升高到0.30%时,有序的凝胶网络结构再次形成,且其中包含了叠加的次级网络结构,这使蛋白分子与水相的整体接触面积变大,蛋白与水之间的相互作用也得到增强;凝胶中的大量小孔径结构还能有效地束缚水分[55],故凝胶的保水性得到改善,凝胶结构对弹性形变的应力提高。Jao等[56]的研究也发现当超过50%的ATP酶失活时,高压肌球蛋白能够形成良好的凝胶网络结构,这也与前文ATP酶活力的结果一致。三聚磷酸钠质量分数为0.30%的肌球蛋白经100、200 MPa超高压处理后,其溶解度和ATP酶活力改变,升温过程中蛋白结构域充分展开并形成交联,促进了分子间相互作用力的形成。这有利于有序凝胶网络的形成,并最终使凝胶的保水性得到提升。 3 结 论不同压力条件下的超高压处理和蛋白体系中三聚磷酸钠的质量分数均会影响肌球蛋白的结构与溶解度、ATP酶活力等理化特性,并改变其热胶凝过程中的变性速率及交联方式,最终导致凝胶保水性的变化。100、200 MPa超高压处理后,含0.15%三聚磷酸钠的肌球蛋白的溶解度显著下降,ATP酶活力显著上升(P<0.05)。低质量分数三聚磷酸钠呈现出对超高压处理的拮抗作用,蛋白在升温过程中的分子构象变化也受抑制。而随着三聚磷酸钠质量分数升高到0.30%,拮抗作用消失,升温过程中蛋白的结构充分展开,疏水基团与所包埋的巯基快速暴露,蛋白连结形成有序的凝胶网络结构,凝胶的保水性也显著上升(P<0.05)。而300 MPa超高压处理会使蛋白的溶解度大幅下降(P<0.05),ATP酶活力丧失,蛋白在升温过程中的变性与解折叠程度低,形成的分子间交联弱,最终导致凝胶保水性的显著下降(P<0.05)。 参考文献: [1] FEINER G. Meat products handbook: practical science and technology[M]. Cambridge: Woodhead Publishing Limited, 2006: 73-77. [2] XIONG Youling L., LOU Xin, WANG Chong, et al. Protein extraction from chicken myofibrils irrigated with various polyphosphate and NaCl solutions[J]. Journal of Food Science, 2000, 65(1): 96-100.doi:10.1111/j.1365-2621.2000.tb15962.x. [3] SHERMAN R A, MEHTA O. Phosphorus and potassium content of enhanced meat and poultry products: implications for patients who receive dialysis[J]. Clinical Journal of the American Society of Nephrology, 2009, 4(8): 1370-1373. doi:10.2215/CJN.02830409. [4] VILLAMONTE G, SIMONIN H, DURANTON F, et al. Functionality of pork meat proteins: impact of sodium chloride and phosphates under high-pressure processing[J]. Innovative Food Science & Emerging Technologies, 2013, 18: 15-23. doi:10.1016/j.ifset.2012.12.001. [5] LOWDER A C, MIRELES DEWITT C A. Impact of high pressure processing on the functional aspects of beef muscle injected with salt and/or sodium phosphates[J]. Journal of Food Processing and Preservation, 2014, 38(4): 1840-1848. doi:10.1111/jfpp.12155. [6] 徐幸莲. 兔骨骼肌肌球蛋白热诱导凝胶特性及成胶机制研究[D].南京: 南京农业大学, 2003: 13-103. [7] FERRY J D. Protein gels[J]. Advances in Protein Chemistry, 1948, 4:1-78. doi:10.1016/S0065-3233(08)60004-2. [8] PIGHIN D G, SANCHO A M, GONZALEZ C B. Effect of salt addition on the thermal behavior of proteins of bovine meat from Argentina[J]. Meat Science, 2008, 79(3): 549-556. doi:10.1016/j.meatsci.2007.12.011. [9] FINDLAY C J, BARBUT S. A response surface investigation of the effects of sodium chloride and tripolyphosphate on the thermal properties of beef muscle[J]. Meat Science, 1992, 31(2): 155-164.doi:10.1016/0309-1740(92)90035-3. [10] SPERONI F, SZERMAN N, VAUDAGNA S R. High hydrostatic pressure processing of beef patties: effects of pressure level and sodium tripolyphosphate and sodium chloride concentrations on thermal and aggregative properties of proteins[J]. Innovative Food Science and Emerging Technologies, 2014, 23: 10-17. doi:10.1016/j.ifset.2014.03.011. [11] KIJOWSKI J M, MAST M G. Effect of sodium chloride and phosphates on the thermal properties of chicken meat proteins[J].Journal of Food Science, 1988, 53(2): 367-370. doi:10.1111/j.1365-2621.1988.tb07707.x. [12] CAO Yingying, XIA Tianlan, ZHOU Guanghong, et al. The mechanism of high pressure-induced gels of rabbit myosin[J].Innovative Food Science and Emerging Technologies, 2012, 16: 41-46.doi:10.1016/j.ifset.2012.04.005. [13] 汪家政, 范明. 蛋白质技术手册[M]. 北京: 科学出版社, 2001: 77-110. [14] 郭尧君. 蛋白质电泳实验技术[M]. 北京: 科学出版社, 2001: 86. [15] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.doi:10.1038/227680a0. [16] XUE Siwen, YANG Huijuan, YU Xiaobo, et al. Applications of high pressure to pre-rigor rabbit muscles affect the water characteristics of myosin gels[J]. Food Chemistry, 2018, 240: 59-66. doi:10.1016/j.foodchem.2017.07.096. [17] 王梦瑶. 超高压诱导兔肉肌球蛋白及其亚基热凝胶机制研究[D]. 南京: 南京农业大学, 2017: 57-64. [18] CHEN Xing, CHEN Conggui, ZHOU Yanzi, et al. Effects of high pressure processing on the thermal gelling properties of chicken breast myosin containing κ-carrageenan[J]. Food Hydrocolloids, 2014, 40:262-272. doi:10.1016/j.foodhyd.2014.03.018. [19] KOCHER P N, FOEGEDING E A. Microcentrifuge-based method for measuring water-holding of protein gels[J]. Journal of Food Science,1993, 58(5): 1040-1046. doi:10.1111/j.1365-2621.1993.tb06107.x. [20] 田金河. 高强度超声波辅助制备罗非鱼分离蛋白及其凝胶特性的研究[D]. 广州: 华南理工大学, 2015: 56-57. [21] 薛思雯, 邹玉峰, 杨慧娟, 等. 氯化钠浓度对僵直前高压处理兔肉中肌球蛋白凝胶保水性及其胶凝过程中分子特性和结构变化的影响[J]. 食品工业科技, 2017, 38(3): 97-101; 107. doi:10.13386/j.issn1002-0306.2017.03.010. [22] ELLMAN G L. Tissue sulfhydryl groups[J]. Archives of Biochemistry and Biophysics, 1959, 82(1): 70-77. doi:10.1016/0003-9861(59)90090-6. [23] SMYTH A B, SMITH D M, VEGA-WARNER V, et al. Thermal denaturation and aggregation of chicken breast muscle myosin and subfragments[J]. Journal of Agricultural and Food Chemistry, 1996,44(4): 1005-1010. doi:10.1021/jf950581p. [24] 周光宏, 罗欣, 徐幸莲. 肉品加工学[M]. 北京: 中国农业出版社,2008: 66-70. [25] 曹莹莹, 张亮, 王鹏, 等. 超高压结合热处理对肌球蛋白凝胶特性及蛋白二级结构的影响[J]. 肉类研究, 2013, 27(1): 1-7. doi:10.7506/rlyj1001-8123-201301001. [26] TINTCHEV F, BINDRICH U, TOEPFL S, et al. High hydrostatic pressure/temperature modeling of frankfurter batters[J]. Meat Science,2013, 94(3): 376-387. doi:10.1016/j.meatsci.2013.02.012. [27] WANG S F, SMITH D M. Gelation of chicken breast muscle actomyosin as influenced by weight ratio of actin to myosin[J].Journal of Agricultural and Food Chemistry, 1995, 43(2): 331-336.doi:10.1021/jf00050a013. [28] 彭增起. 肌肉盐溶蛋白质溶解性和凝胶特性研究[D]. 南京: 南京农业大学, 2005: 3-10. [29] 薛思雯, 钱畅, 王梦瑶, 等. 肌球蛋白高压凝胶机理的研究进展[J]. 肉类研究, 2016, 30(10): 40-44. doi:10.15922/j.cnki.rlyj.2016.10.008. [30] YAMAMOTO K, YOSHIDA T, IWASAKI T. Hydrostatic pressureinduced solubilization and gelation of chicken myofibrils: progress in biotechnology[J]. Progress in Biotechnology, 2002, 19: 461-468.doi:10.1016/S0921-0423(02)80139-3. [31] YAMAMOTO K, HAYASHI S, YASUI T. Hydrostatic pressureinduced aggregation of myosin molecules in 0.5 M KCl at pH 6.0[J].Bioscience, Biotechnology, and Biochemistry, 1993, 57(3): 383-389.doi:10.1271/bbb.57.383. [32] ZHANG Ziye, YANG Yuling, ZHOU Peng, et al. Effects of high pressure modification on conformation and gelation properties of myofibrillar protein[J]. Food Chemistry, 2017, 217: 678-686.doi:10.1016/j.foodchem.2016.09.040. [33] HSU K C, KO W C. Effect of hydrostatic pressure on aggregation and viscoelastic properties of tilapia (Orechromis niloticus) myosin[J].Journal of Food Science, 2008, 66(8): 1158-1162. doi:10.1111/j.1365-2621.2001.tb16098.x. [34] IKEUCHI Y, TANJI H, KIM K, et al. Mechanism of heat-induced gelation of pressurized actomyosin: pressure-induced changes in actin and myosin in actomyosin[J]. Journal of Agricultural and Food Chemistry, 1992, 40(10): 1756-1761. doi:10.1021/jf00022a006. [35] YAMAMOTO K, YOSHIDA Y, MORITA J, et al. Morphological and physicochemical changes in the myosin molecules induced by hydrostatic pressure[J]. The Journal of Biochemistry, 1994, 116(1):215-220. doi:10.1093/oxfordjournals.jbchem.a124496. [36] IWASAKI T, YAMAMOTO K. Effect of high hydrostatic pressure on chicken myosin subfragment-1[J]. International Journal of Biological Macromolecules, 2002, 30(5): 227-232. doi:10.1016/S0141-8130(02)00037-5. [37] MUHLRAD A, PEYSER Y M, RINGEL I. Effect of actin, ATP,phosphates, and pH on vanadate-induced photocleavage of myosin subfragment 1[J]. Biochemistry, 1991, 30(4): 958-965. doi:10.1021/bi00218a011. [38] EGELANDSDAL B, FRETHEIM K, SAMEJIMA K. Dynamic rheological measurements on heat-induced myosin gels: effect of ionic strength, protein concentration and addition of adenosine triphosphate or pyrophosphate[J]. Journal of the Science of Food and Agriculture,1986, 37(9): 915-926. doi:10.1002/jsfa.2740370914. [39] BLUM J J. Interaction between myosin and its substrates[J].Archives of Biochemistry and Biophysics, 1960, 87(1): 104-119.doi:10.1016/0003-9861(60)90130-2. [40] JIN Hongguo, XIONG Youling L., PENG Zengqi, et al. Purif i cation and characterization of myosin-tripolyphosphatase from rabbit Psoas major muscle: research note[J]. Meat Science, 2011, 89(4): 372-376.doi:10.1016/j.meatsci.2010.10.014. [41] 靳红果. 猪肉多聚磷酸酶调控肌肉蛋白质凝胶特性的研究[D]. 南京: 南京农业大学, 2011: 89-95. [42] 林丽军. 肌球蛋白的ATPase活性及热凝胶特性研究[D]. 南京: 南京农业大学, 2004: 35-43. [43] FERNÁNDEZ-MARTÍN F, COFRADES S, CARBALLO J, et al. Salt and phosphate effects on the gelling process of pressure/heat treated pork batters[J]. Meat Science, 2002, 61(1): 15-23. doi:10.1016/S0309-1740(01)00157-7. [44] 胡飞华. 梅鱼鱼糜超高压凝胶化工艺及凝胶机理的研究[D]. 杭州:浙江工商大学, 2010: 70-91. [45] 郭添玥. 氯化钠和三聚磷酸钠对超高压鸡肉制品凝胶特性的影响[D].南京: 南京农业大学, 2015: 46-47. [46] 曾淑薇, 李吉, 熊善柏, 等. 磷酸盐对草鱼肌原纤维蛋白结构的影响[J]. 食品科学, 2014, 35(23): 48-51. doi:10.7506/spkx1002-6630-201423010. [47] LIU Gang, XIONG Youling L.. Gelation of chicken muscle myof i brillar proteins treated with protease inhibitors and phosphates[J].Journal of Agricultural and Food Chemistry, 1997, 45(9): 3437-3442.doi:10.1021/jf9700485. [48] WRIGHT D J, WILDING P. Differential scanning calorimetric study of muscle and its proteins: myosin and its subfragments[J]. Journal of the Science of Food and Agriculture, 1984, 35(3): 357-372.doi:10.1002/jsfa.2740350317. [49] ROBE G H, XIONG Youling L.. Dynamic rheological studies on saltsoluble proteins from three porcine muscles[J]. Food Hydrocolloids,1993, 7(2): 137-146. doi:10.1016/S0268-005X(09)80165-3. [50] HENRY G D, MARUTA S, IKEBE M, et al. Observation of multiple myosin subfragment 1-ADP-f l uoroberyllate complexes by fl uorine-19 NMR spectroscopy[J]. Biochemistry, 1993, 32(39): 10451-10456.doi:10.1021/bi00090a022. [51] SHRIVER J W, KAMATH U. Differential scanning calorimetry of the unfolding of myosin subfragment 1, subfragment 2, and heavy meromyosin[J].Biochemistry, 1990, 29(10): 2556-2564. doi:10.1021/bi00462a018. [52] VERBEKEN D, NEIRINCK N, VAN DER MEEREN P, et al.Influence of κ-carrageenan on the thermal gelation of salt-soluble meat proteins[J]. Meat Science, 2005, 70(1): 161-166. doi:10.1016/j.meatsci.2004.12.007. [53] XUE Siwen, YANG Huijuan, WANG Huhu, et al. High-pressure effects on the molecular aggregation and physicochemical properties of myosin in relation to heat gelation[J]. Food Research International,2017, 99: 413-418. doi:10.1016/j.foodres.2017.06.014. [54] WANG Mengyao, CHEN Xing, ZOU Yufeng, et al. High-pressure processing-induced conformational changes during heating affect water holding capacity of myosin gel[J]. International Journal of Food Science & Technology, 2017, 52(3): 724-732. doi:10.1111/ijfs.13327. [55] HAN Minyi, WANG Peng, XU Xinglian, et al. Low-f i eld NMR study of heat-induced gelation of pork myofibrillar proteins and its relationship with microstructural characteristics[J]. Food Research International, 2014,62: 1175-1182. doi:10.1016/j.foodres.2014.05.062. [56] JAO C L, HWANG J S, KO W C, et al. A kinetic study on inactivation of tilapia myosin Ca-ATPase induced by high hydrostatic pressure[J]. Food Chemistry, 2007, 101(1): 65-69. doi:10.1016/j.foodchem.2005.11.051.
Effects of Ultra-high Pressure Processing and Sodium Tripolyphosphate Contents on Water-Holding Capacity of Myosin Gel and Its Heat-Induced Gelation Process QIAN Chang, XUE Siwen, XU Xinglian*, ZHOU Guanghong*
(National Center of Meat Quality and Safety Control, Key Laboratory of Meat Processing and Quality Control, Ministry of Education,Key Laboratory of Meat Products Processing, Ministry of Agriculture, Jiangsu Collaborative Innovation Center of Meat Production and Processing,Quality and Safety Control, Nanjing Agricultural University, Nanjing 210095, China) Abstract: To investigate the effect of ultra-high pressure (UHP) processing and sodium tripolyphosphate (STPP) contents on the water-holding capacity (WHC) of myosin gel and the heat-induced gelation process, rabbit Psoas major myosin dialyzed against different STPP concentrations (0%, 0.15%, 0.30% or 0.45%) were subjected to UHP treatments (25 ℃,9 min) at different pressure levels (100, 200 and 300 MPa) before programmed heating (1 ℃/min) to form gels. Unpressurized myosin containing 0.30% STPP was set as the control. The WHC was measured to fi lter the parameters that had signif i cant effects on gel properties. The protein solubility and ATPase activity and changes in the secondary structure content, surface hydrophobicity, reactive sulfhydryl group content, and rheological properties as well as the gel microstructure during heating were measured. The results indicated that the solubility of myosin containing 0.15% STPP decreased, while its ATPase activity increased signif i cantly (P < 0.05) after pressure treatments below 200 MPa, which indicates that 0.15%STPP could counteract pressure-induced changes in functional properties of myosin. The denaturation and agglomeration process were hindered as well. The counteractive effect was diminished with the increase in STPP content up to 0.30%.The protein underwent suff i cient unfolding as well as rapid exposure of buried residues during gelling, which resulted in an elastic, compact and ordered gel network structure and a signif i cant increase in WHC (P < 0.05). The ATPase of myosin was inactivated under 300 MPa, and its solubility decreased as well. The extent of protein denaturation was reduced and intermolecular cross-linking was weakened. As a result, the WHC decreased signif i cantly (P < 0.05). STPP appears to affect the structure and physiochemical properties of myosin, leading to alteration in its denaturation rate and cross-linking pattern during heating and consequently change in WHC eventually. Keywords: myosin; ultra-high pressure; sodium tripolyphosphate; water-holding capacity; gel
|  |Archiver|手机版|小黑屋|www.openhelp100.com
( 冀ICP备19026749号-1 )
|Archiver|手机版|小黑屋|www.openhelp100.com
( 冀ICP备19026749号-1 )